时间:2017-11-05 23:07:13
1、选择题 25 ℃时,在等体积的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是(? )
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
2、选择题 下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是(?)
A.CH3COOH
B.Al2(SO4)3
C.NaOH
D.Na2CO3
3、选择题 在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是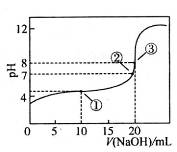
A.该中和滴定过程,最宜用石蕊作指示剂
B.图中点②所示溶液中,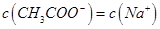
C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度
D.滴定过程中的某点,会有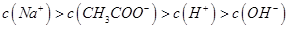 的关系存在
的关系存在
4、选择题 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是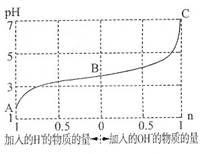
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
5、选择题 常温下pH=6的盐酸和pH=6的NH4Cl溶液,其中由水电离出的c(H+)分别为x mol/L、y mol/L,则x与y的关系是(? )
A.x=10-2y
B.x >y
C.x=y
D.x=102y