时间:2017-11-05 23:07:13
1、选择题 关于常温下pH=3的醋酸溶液,下列叙述正确的是
A.加水稀释10倍后,pH=4
B.加水稀释后,溶液中c(H+)和c(OH-)均减少
C.加入醋酸钠晶体后,溶液的pH增大
D.加入等体积、pH=11的NaOH溶液后,c(Na+)= c(CH3COO-)
2、填空题 (4分)(1)1g 硫粉在O2中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式
。
(2)若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。则乙炔燃烧的热化学方程式为 。
3、选择题 下列关于热化学反应的描述中正确的是
[? ]
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应中和热 ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是-283.0 kJ/mol,则2CO(g)+O2(g) =2CO2(g)反应的ΔH=-(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
4、选择题 将0.l mol·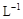 氨水溶液加水稀释,下列说法正确的是?
氨水溶液加水稀释,下列说法正确的是?
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(OH-)增大
C.NH3·H2O电离平衡向左移动
D.溶液的pH减小
5、选择题 下列叙述中正确的是
A.含金属元素的离子都是阳离子
B.将体积相同pH均为1的盐酸和醋酸加水稀释至pH为3,盐酸的体积变化大,
证明醋酸是弱酸
C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合液滴加1~2滴0.01mol·L-1
AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小
D.金属阳离子被还原不一定得到金属单质