时间:2017-11-05 22:36:11
1、简答题 如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”).
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为______.
④若乙池转移0.02mole-后停止实验,池中溶液体积是200mL,则溶液混合匀后的pH=______.
2、选择题 关于如图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过检流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e-=H2↑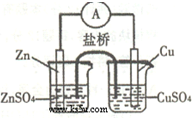
3、填空题 (1)利用下图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于_____处。若X为锌,开关K置于M处,该电化学防护法称为____________________。 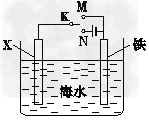
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为______极,该极的电极反应式是______________________________,电池工作一段时间后,电解质溶液的pH 将________(填“增大”、“减小”、“不变”)。
(3)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,可通过电解制备碘酸钾。(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:
①电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为_________________________________。
②电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。? 
4、选择题 已知反应AsO43-+2I-+2H+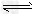 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%?NaOH溶液
结果发现电流计指针均发生偏转。据此,下列判断正确的是 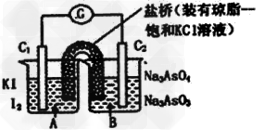
[? ]
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O
D.Ⅱ操作过程中,C1棒上发生的反应为:2I-―2e-=I2
5、简答题 Zn-Cu构成原电池,电解液是2000mL硫酸铜溶液,若两电极的总质量为160g,工作一段时间后,取出Zn片和Cu片洗净干燥后称重,总质量为158g,试计算:
(1)通过导线中电子的个数?
(2)假设硫酸铜溶液消耗完,则硫酸铜溶液得物质的量浓度为多少?