时间:2017-11-05 22:36:11
1、填空题 (16分).铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体。由图 1 知金属铬的活动性比铜_____(填强,弱),图 2装置中铬电极的电极反应式??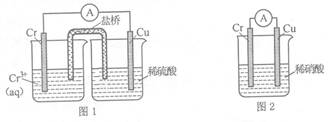
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸, CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为_____________________________________________________________。
(3)存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①若平衡体系的pH=2,则溶液显?色.
②能说明第①步反应达平衡状态的是?。
a.Cr2O72—和CrO42—的浓度相同? b.2v (Cr2O72—) ="v" (CrO42—)? c.溶液的颜色不变
(4)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L1,则溶液中c(Cr3+)为____ mol·L-1。
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。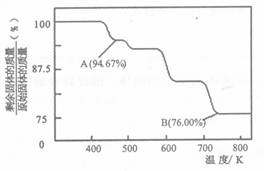
从开始加热到 750K 时总反应方程式为_______________________。
参考答案:(共16分)(1)由图 1 知金属铬的活动性比铜强? NO+4H+?+3e-? ="?" NO↑+2H2O
(2)4CrO3+3C2H5OH+6H2SO42Cr2(SO4)3+3CH3COOH+9H2O
(3)①?橙色 ?②c
(4)①增强溶液的导电性?②3.0×10-6
(5) 4CrO32Cr2O3+3O2↑
本题解析:略
本题难度:一般
2、选择题 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性.根据这一特点科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程式为:
2Cu+Ag2O=Cu2O+2Ag.下列有关说法不正确的是( )
A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中,Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
参考答案:B
本题解析:
本题难度:简单
3、选择题 有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b,阴离子所带负电荷数c>d,则四种元素的原子序数关系是( )
A.a>b>c>d
B.b>a>d>c
C.c>b>a>d
D.b>a>c>d
参考答案:B
本题解析:略
本题难度:简单
4、选择题 已知:锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S Li2S
Li2S
有关上述两种电池说法正确的是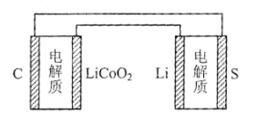
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.右图表示用锂离子电池给锂硫电池充电
参考答案:B
本题解析:A、电池放电时,电解质内部Li+向正极移动,错误;B、锂硫电池充电时,锂电极发生得电子反应,为还原反应,正确;C、两种电池的变价不同,所以比能量不相同,错误;D、充电时正接正,负接负,所以Li电极连接C电极,错误。
本题难度:一般
5、填空题 (9分)近期“五水共治”越来越引起人们的重视。对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为 ;
②简述浓缩室中得到浓乳酸的原理 ;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90g/ mol )。
参考答案:(1) ①负 (1分) 
(2)①4OH- - 4e- = 2H2O + O2↑ (2分)
②阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室(1分);A-通过阴离子交换膜从阴极进入浓缩室,H++A— = HA,乳酸浓度增大(1分) ③ 6.72 (2分)
本题解析:(1)①根据装置图可知氢离子向A电极移动,这说明A电极是正极,则B电极是负极。
②A极是正极,得到电子发生还原反应,则电极反应式为 。
。
(2)①电解池中阳极失去电子发生氧化反应,阳极加入硫酸,则溶液中的氢氧根离子放电,电极反应式为4OH- - 4e- = 2H2O + O2↑。
②阳极OH-放电,导致溶液中c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,二者结合生成HA,即H++A—=HA,从而导致乳酸浓度增大。
③反应后增加的乳酸质量是0.4L×(145g/L—10g/L)=54g,物质的量是54g÷90g/mol=0.6mol,因此结合氢离子的物质的量是0.6mol,根据电荷守恒可知生成的氢气是0.3mol,在标准状况下的体积是6.72L。
考点:考查电化学原理的应用
本题难度:困难