时间:2017-11-05 21:00:41
1、选择题 下列实验操作或事故处理中,正确的做法是(?)
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在中学《硫酸铜晶体里结晶水含量测定》的实验,称量操作至少需要四次
C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
D.在250ml 烧杯中,加入216g水和24g NaOH固体,配制10% NaOH溶液
参考答案:B
本题解析:
【错解分析】误选D.此题考查了实验操作的基本方法及事故处理方法。要掌握此类题的解法,必须正确掌握意外事故的处理方法,还有要掌握易变质和具危险性药品的特性及保存方法。
【正解】A、银不溶于稀硫酸,A、错误。浓硫酸沾在皮肤上应先用干布擦净再用大量水冲洗。NaOH溶液有强腐蚀性,所以C错误。D中配制溶液约216ml 用250ml烧杯过小,一般配制溶液所选的容量约为所制溶液体积的2倍,所以D错误。B项先称坩埚的质量,然后用坩埚准确称取2.0g硫酸铜晶体(已研碎),加热失水后冷却称量,再加热再称量,到连续两次质量差不超过0.1g为止。最少四次称量。
本题难度:简单
2、实验题 某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
(1)假设3:?。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是?
?;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设?成立;若出现血红色,则假设?成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
?现象,则假设1成立;反之,则假设3成立。
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理??(填“是”或“否”),理由是 ?。
参考答案:(9分)(1)催化剂中铁元素既有+3价又有+2价(2分); 91ExAM.org
(2)除去硫酸中溶解的氧气(1分);
(3)2(1分);? 1或3(1分);?(4)高锰酸钾溶液不褪色(1分);
(5)否(1分);?加入硝酸会将Fe2+氧化成Fe3+(2分)
本题解析:(1)根据所给的假设1和2可知,假设3应该是催化剂中铁元素既有+3价又有+2价。
(2)由于氧气也具有氧化性,能氧化亚铁离子,所以加热煮沸数分钟的目的是除去硫酸中溶解的氧气。
(3)由于铁离子能和KSCN溶液反应显红色,所以若不出现血红色,则假设2成立。若出现血红色,则假设1或3成立。
(4)亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而褪色,所以如果出现高锰酸钾溶液不褪色现象,则假设1成立;反之,则假设3成立。
(5)由于硝酸具有氧化性,则加入硝酸会将Fe2+氧化成Fe3+,从而导致实验结论不准确。
点评:该题是中等难度的试题,也是高考中的常见题型,侧重对学生实验能力的培养,有利于激发学生的学习兴趣和学习积极性。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
3、实验题 MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
(1)用硫酸调整溶液pH到1~2,硫酸的作用是?。 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是????(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:??。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是????(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:??。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是?。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是?。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→?。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO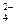 )=?。
)=?。
参考答案:
本题解析:略
本题难度:一般
4、实验题 某化学兴趣小组利用如图所示装置(部分夹持仪器已省略) 进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题。

参考答案:(1)黑色固体变为红色,硬质玻璃管右端管壁有液滴生成
(2)A;收集H2,并检验其纯度
本题解析:
本题难度:一般
5、实验题 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、?、?等。
②称量?g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、?。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用?(填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。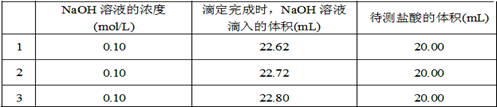
①滴定达到终点的标志是?。
②根据上述数据,可计算出该盐酸的浓度约为?(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的?,然后轻轻挤压玻璃球使尖嘴部分充满碱液。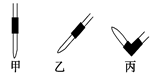
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有?。
A.滴定终点读数时俯视读数
B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E. 酸式滴定管使用前,水洗后未用待测盐酸润洗
参考答案:(1)①100 mL容量瓶?胶头滴管?②0.4?烧杯(或表面皿)
(2)碱式滴定管①最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色?②0.11mol/L?③丙?④B D
本题解析:(1)配制100 mL 0.10 mol/L NaOH标准溶液需要的仪器有烧杯、量筒、玻璃棒、100 mL容量瓶、胶头滴管;100 mL 0.10 mol/L NaOH中含有的NaOH的质量m=0.10×100/1000×40g=0.4g,所以应该称取0.4g氢氧化钠固体,由于氢氧化钠易潮解,故需要使用烧杯(或表面皿);(2)标准液NaOH溶液应该装在碱式滴定管中,不能用酸式滴定管;①该滴定实验室用标准氢氧化钠溶液滴定酸,故其滴定终点是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色;②根据上述数据,可计算出该盐酸的浓度约为(22.62+22.72+22.80)/3×0.10/20=0.11mol/L;③排去碱式滴定管中气泡的方法应采用丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液;④滴定终点读数时俯视读数,即导致读数比实际消耗的体积小,故测定的酸的浓度偏小,故A不能选;碱式滴定管尖嘴部分有气泡,滴定后消失,即导致读数比实际消耗的大,故测定的酸的浓度偏高,故B可以选择;锥形瓶水洗后未干燥,对结果么有影响,故C不能选;配制标准溶液的氢氧化钠中混有Na2CO3杂质,由于氢氧化钠的性对分子量为40,而碳酸钠的性对分子量为100,而消耗盐酸时两个氢氧化钠分子与一个碳酸钠分子相同,故折算起来的标准的氢氧化钠的浓度偏小,所以测定的结果就偏高,故D可以选择;酸式滴定管使用前,水洗后未用待测盐酸润洗,故测定的酸的浓度偏低,故本题的答案选择BD。
点评:本题考查了溶液的配置、酸碱滴定的相关知识,该考点是高考考查的重点和难点,本题有一定能够的综合性,该题有利于培养学生的分析能力,本题难度中等。
本题难度:一般