时间:2017-11-05 21:00:41
1、实验题 (1)用简单的实验证明在氨水中存在NH3·H2O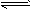 NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。
NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。
(2)老师给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明醋酸是弱酸。药品为冰醋酸、蒸馏水和pH试纸。此同学思考后认为:
①设计的理论依据是_______________________________________;
②实验的简要步骤是_______________________________________;
③需记录的现象和数据是__________________________________;
④推断与分析:由于___________________________,说明________________,所以醋酸是弱酸。
参考答案:(1)在氨水中滴入酚酞试液变红,加入醋酸铵固体,振荡,溶液颜色明显变浅,说明c(OH-)减小,是
c(NH4+)增大平衡左移而造成的,由此证明氨水中存在着电离平衡
(2)①弱电解质稀释10a倍,pH改变小于a
②将一定浓度的醋酸稀释到一定量(如100倍)后,测量稀释前后溶液的pH
③稀释的倍数、稀释前后溶液的pH
④溶液稀释100倍后,溶液的pH改变小于2;稀释过程中醋酸的电离程度增大
本题解析:
本题难度:一般
2、选择题 a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且a、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应.下列推理不正确的是( )
A.a一定为KOH溶液
B.b一定为KHSO4溶液
C.c一定为AlCl3溶液
D.e一定为MgCl2溶液
参考答案:MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中,KOH能与其余四种溶液反应,故a为KOH,MgCl2只能与KOH反应,e为MgCl2,KHSO4、KOH之间的反应没有明显现象,所以d为KHSO4,KHSO4和NaHCO3反应只产生气泡,所以b为NaHCO3,c为AlCl3.
A、a为KOH,故A正确;
B、b为NaHCO3,故B错误;
C、c为AlCl3溶液,故C正确;
D、e为MgCl2,故D正确.
故选B.
本题解析:
本题难度:简单
3、实验题 (15分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)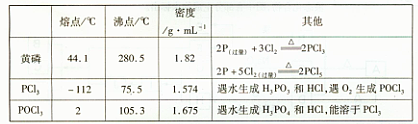
(1)仪器乙的名称?;
(2)实验室制备Cl2的离子方程式:?;
(3)碱石灰的作用是?,?;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是?。
(二)提纯
粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过____(填实验操作名称),即可得到PCl3的纯品。
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出2 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为?(用含字母的代数式表示、不必化简)
参考答案:
本题解析:(一)(1)冷凝管,起冷却回流作用;(2)可用MnO2氧化浓盐酸制Cl2;(3)碱石
灰的作用一方面吸收Cl2,防止污染空气,一方面防止空气中的水进入而使PCl3水解;(4)
因PCl3可被氧气氧化,与水反应,所以整个装置要除氧、除水;(二)根据表中的信息,可
通过蒸馏的方法除去PCl3中的杂质;
(三)根据关系式PCl3~H3PO3~I2可求m(PCl3)=137.5x(c1V1-1/2c2V2)x500/25x10-3。
本题难度:一般
4、填空题 (16分)某化学兴趣小组同学,用下列各仪器装置制取乙烯,并用过量的氧气将C2H4氧化成CO2和H2O,测定乙 烯中碳、氢两种元素的质量比。
烯中碳、氢两种元素的质量比。
回答下列问题: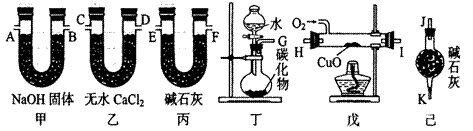
(1)该同学受实验室制备C2H2的启发,拟从CaC2、ZnC2、Al4C3、Mg2C2、Li2C2中选择一种试剂与水反应来制备乙烯,写出该反应的化学 方程式:?。
方程式:?。
(2)若产生的气体由左向右流向,各装置导管的连接顺序是:G接E、F接?、?接
?、?接A、B接J。
(3)装置甲的作用是?;
装置己的作用是?。
(4)装置戊中CuO的作用是?。
(5)实验前称得甲、乙两装置的质量分别为m1g和n1g,实验完毕,称得甲、乙两装置的质量分别变为m2g和n2g,则乙烯分子中碳原子和氢原子的原子个数比为?(列出算式)。
(6)若戊中没有CuO,则测定结果?(填“偏高”、“偏低”或“不变”,下同);若不接丙装置,则测定结果? ?。
?。
参考答案:
本题解析:略
本题难度:一般
5、实验题 某研究性学习?小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设?
①该反应的气体产物是CO2。 ②该反应的气体产物是CO。 ③该反应的气体产物是_____________。
设计方案?
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。 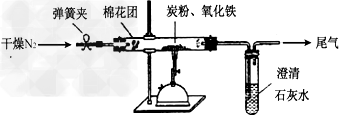
(2)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式____________________。
②该实验装置与实验室制取下列气体相同的是________(填标号);
A、用稀盐酸和锌反应制H2?
B、用MnO2和浓盐酸加热反应制Cl2?
C、用KClO3与MnO2共热反应制O2
(3)实验步骤
①?按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为________。
(4)数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式
________________________。
(5)实验优化?
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是________________。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:________。
参考答案:(1)CO2、CO的混合物
(2)NH4++NO2-==?N2↑+2H2O;B
(3)步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收
(4)2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
(5)①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M(BaCO3)>M(CaCO3),称量时相对误差小;②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
本题解析:
本题难度:一般