时间:2017-11-05 20:54:49
1、选择题 下图所示各种装置中能构成原电池的是
A.①②③
B.④⑤⑥
C.①③⑤
D.②④⑥
2、选择题 铜锌原电池(如图)工作时,下列叙述正确的是 ( )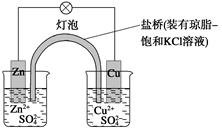
A.正极反应为:Zn-2e-===Zn2+
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液
3、选择题 X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是
[? ]
A.X>Y>Z
B.Z>Y>X
C.X>Z>Y
D.Y>X>Z
4、选择题 某原电池的总反应方程式为:2Fe3+ +Cu=== 2Fe2+ + Cu2+,能实现该反应的为( )
| ? | A | B | C | D | |||||||||||||||||||||||||||||||||||||||||||
| 正极材料 | Cu | 石墨 | Fe | Ag | |||||||||||||||||||||||||||||||||||||||||||
| 负极材料 | Fe | Cu | Cu | Cu | |||||||||||||||||||||||||||||||||||||||||||
| 电解质液 | CuSO4 | Fe2(SO4)3 | FeCl3 | AgNO3 5、填空题 低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
(1)上述正反应方向是?反应(填“放热”或“吸热”)。 (2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)。 t1℃时物质浓度(mol/L)的变化 
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。 ②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。 A.增加水蒸气? B.降低温度? C.使用催化剂? D.增加氢气浓度 (4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:?。 (5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为?。 (6) 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知: N2(g) + 2O2(g) =2NO2(g)?△H =" +67.7" kJ·mol-1 N2H4(g) + O2(g) =N2(g) + 2H2O(g)?△H = -534.0 kJ·mol-1 NO2(g)  1/2N2O4(g)?△H = -26.35 kJ·mol-1 1/2N2O4(g)?△H = -26.35 kJ·mol-1试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ________________________________________________________。 |