时间:2017-11-05 20:41:47
1、选择题 常温时,以下4种溶液pH最大的是
[? ]
A.0.01mol·L-1氨水溶液
B.0.02mol·L-1氨水与0.02mol·L-1盐酸溶液等体积混合液
C.0.03mol·L-1氨水与0.01mol·L-1盐酸溶液等体积混合液
D.pH =2的盐酸与pH =12的Ba(OH)2溶液等体积混合液
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列溶液中微粒的物质的量浓度关系正确的是
[? ]
A.室温下,向0.01mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>
c(OH-)=c(H+)
B.0.1mol·L-1 NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
C.Na2CO3溶液:c(OH-) +c(H+)=c(HCO3-)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+
c(OH-)<c(CH3COOH)+c(H+)
参考答案:A
本题解析:
本题难度:一般
3、简答题 已知某温度下,0.1mol/L的NaHB强电解质溶液中,c(H+)>c(OH-),则下列各关系式一定正确的是( )
A.c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
B.溶液的pH=1
C.c(Na+)=0.1mol/L≥c(B2-)
D.c(H+)-c(OH-)=10-14
参考答案:A.根据题意,NaHB是强电解质,溶液呈酸性,如果存在HB-,则 HB-?的电离程度大于水解程度,即?NaHB溶液中含有的离子是(Na+)、(H+)、c(HB-)、c(B2-)、c(OH-),根据电荷守恒得:c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),故A错误;
B.NaHB是强电解质,溶液呈酸性,可能有两种情况,即HB-能够完全电离,也可能部分电离.当HB-完全电离时,0.1mol/L的NaHB的pH=1,当HB-部分电离时,0.1mol/L的NaHB的pH>1.故B错误;
C.NaHB是强电解质,说明0.1mol/L的NaHB的溶液中c(Na+)=0.1mol/L.根据B项的分析,当HB-完全电离时,0.1mol/L的NaHB的c(B2-)=0.1mol/L,当HB-部分电离时,c(B2-)<0.1mol/L.因此,c(Na+)=0.1mol/L≥c(B2-),故C正确;
D.在0.1mol/L的NaHB溶液中,无法求解氢离子的浓度,因而无法确定c(H+)-c(OH-)=10-14,但是可以知道c(H+)×c(OH-)=10-14,故D错误;
故选C.
本题解析:
本题难度:一般
4、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA- HA- H+ + A2-
H+ + A2-
回答下列问题:
?(1)用离子方程式表示Na2A溶液显"酸性""或中性"或"碱性"的原因 __________________________________________
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B.c(OH-)=c(H+) +c( HA-)+2c(H2A)
C.c(Na+)+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D.c(Na+ ) >c(A2-)>c( HA-) >c(OH-) >c(H+)
(3)常温下,已知0.1mol·L-1NaHA溶液的pH=2,则当H2A溶液中c(H+)为0.11 mol·L-1时,H2A溶液的物质的量浓度应___________ 0.1mol/L(填">"或"<"或"="); 理由是_______________________________。
(4)比较①0.1mol·L-1 Na2A溶液 ②0.1mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①_________ ②(填">"或"<"或"=")。
参考答案:(1)A2- + H2O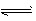 HA- + OH-
HA- + OH-
(2)ABC?
(3)> ;H2A-级电离出H+ ,对HA-电离起抑制作用,而NaHA中不存在抑制
(4)>
本题解析:
本题难度:困难
5、填空题 (1)钢铁在潮湿的空气中发生吸氧腐蚀,其正极的电极反应式为:_______________。
(2)配平下列氧化还原反应方程式:____ FeSO4+___HIO3+____= ___Fe2(SO4)3+___I2+___H2O。
(3)物质的量浓度相同的下列溶液:①NH4NO3②NH4HSO4③CH3COONH4④NH4HCO3⑤(NH4)2CO3,
c(NH4+)由大到小的顺序是(填序号)_____________
参考答案:(1)2H2O+O2+4e-=4OH-
(2)10、2、5H2SO4、5、1、6
(3)⑤>②>①>③>④
本题解析:
本题难度:一般