时间:2017-11-05 20:33:55
1、选择题 下列叙述正确的是? ( )
A.一般认为沉淀离子浓度小于10-4 mol/L时,则认为已经沉淀完全
B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
C.Al(OH)3(s) Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3 Al3++3OH-表示水解平衡
Al3++3OH-表示水解平衡
D.只有反应速率很高的化学反应才能应用于工业生产
参考答案:B
本题解析:沉淀离子浓度小于10-5 mol/L时,则认为已沉淀完全,A项错误。Al (OH)3 Al3++3OH-表示Al(OH)3的电离平衡,C项错误;化学反应能否应用于工业生产与反应速率无必然联系。
Al3++3OH-表示Al(OH)3的电离平衡,C项错误;化学反应能否应用于工业生产与反应速率无必然联系。
本题难度:一般
2、选择题 下列化学实验事实及其解释都正确的是
[? ]
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.向0.1mol·L-1 FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
D.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp
参考答案:AD
本题解析:
本题难度:一般
3、选择题 已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,MgF2的溶度积常数Ksp = 7.4×10-11。下列说法正确的是
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大
C.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小
D.25℃时,在Mg(OH)2的悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化成MgF2
参考答案:A
本题解析:
正确答案:A
A 加入少量的NH4Cl固体,NH4+ 与OH―结合,促进溶解Mg(OH)2平衡正向移动,c(Mg2+)增大;
B不正确,Mg(OH)2的溶度积常数小,c(Mg2+)小
C不正确,溶度积常数只与温度有关;
D、不正确,Mg(OH)2+2F― MgF2+2OH―这是个可逆过程,平衡可正向移动,一定条件下,也可能逆向移动。
MgF2+2OH―这是个可逆过程,平衡可正向移动,一定条件下,也可能逆向移动。
本题难度:简单
4、填空题 炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为 , 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式 。
(3)调节pH过程可以选用 (填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是 。
(4)写出过滤后加入过量的锌粉反应的离子方程式 。
(5)在蒸发浓缩操作时,要采取实验措施是: 。
参考答案:(1)H2SO4溶液 适当升温、充分搅拌、延长溶解时间等(其它答案合理也给分)
(2)2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O(配平错扣1分)
(3)ZnO ,除去Fe3+和Al3+,防止Zn2+沉淀析出
(4)Zn+Cd2+=Zn2++Cd (5)保持一定的酸度(其它表达合理也给分)
本题解析:(1)本题是制备硫酸锌晶体的的工艺流程,锌渣中含有难溶的二氧化硅杂质,选用酸溶除去二氧化硅,考虑尽量少引入杂质,应选含有硫酸根离子的硫酸溶液进行溶解。若要加快浸出速率和提高浸出率,可以适当升高温度或搅拌溶液或适当延长时间等。
(2)用硫酸浸出的滤液中含有少量Fe3+、Al3+、Zn2+、Cd2+、Fe2+ 等离子,考虑这些离子分别沉淀的pH值,应该把Fe2+ 氧化为Fe3+ 在沉淀除去,所以加入氧化剂Ca(ClO)2 发生的反应方式为:2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O。
(3)由于整个流程制备的是硫酸锌晶体,所以在调节pH时要注意不能引入杂质,所以应该选用ZnO调节,而调节pH值到5左右目的是使容易沉淀的Fe3+、Al3+ 先沉淀除去,防止pH过高把生成的Al(OH)3溶解、把Zn2+ 沉淀。
(4)在上步调节完pH后,溶液中还存在杂质离子Cd2+ ,由于Cd2+ 沉淀的pH值与Zn2+ 沉淀的pH值相近,所以不能用沉淀法除去,所以要加入单质Zn把Cd置换出来,因此发生的离子方程式为:Zn+Cd2+=Zn2++Cd。
(5)硫酸锌在蒸发浓缩时容易发生水解,所以为了减少水解产生杂质,应该保持溶液一定的酸度。
考点:本题考查的是化学工艺流程题,本题考的比较基础,常规题型较多。
本题难度:困难
5、选择题 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是 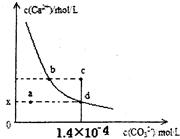
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成 a点
D.b点与d点对应的溶度积相等
参考答案:C
本题解析:略
本题难度:一般