时间:2017-11-05 20:33:55
1、选择题 在BaSO3(s)?Ba2+(aq)+SO32- (aq)平衡体系中,下列措施可使沉淀量减少的是( )
A.加入K2SO3(s)
B.加入稀HNO3
C.加入稀盐酸
D.加入K2SO4(s)
参考答案:A、加入K2SO3(s),K2SO3电离产生SO32-,SO32-的浓度增大,平衡逆向移动,沉淀量增加,故A错误;
B、加入稀HNO3,稀HNO3能氧化BaSO3生成BaSO4,BaSO4的质量比BaSO3大,沉淀量增加,故B错误;
C、加入稀盐酸,稀盐酸能与SO32-反应生成水和SO2,SO32-的浓度减小,平衡正向移动,沉淀量减少,故C正确;
D、加入K2SO4(s),K2SO4(s)电离产生SO42-,SO42-能与Ba2+结合生成BaSO4,BaSO4的溶解积比BaSO3更小,所以BaSO3沉淀转化为BaSO4沉淀,沉淀量增加,故D错误;
故选C.
本题解析:
本题难度:简单
2、填空题 有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙学生在制得的Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:甲同学的解释为:因为NH4Cl溶液中,NH4++H2O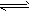 NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s)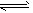 Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg(OH)2的溶解。乙同学的解释为:因为NH4Cl=NH4++Cl-,CH3COONH4=CH3COO-+NH4+,且
Mg(OH)2(s)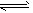 Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg(OH)2的溶解。你认为哪一位同学的解释是正确的?______________________________________________________________________________
参考答案:乙同学的解释是正确的。甲同学认为由NH4+的水解所提供的H+中和了由Mg(OH)2电离出来的OH-,而忽视了NH4Cl电离的NH4+也能结合OH-,且电离的NH4+浓度又远远大于由NH4+水解出来的H+浓度。由于
CH3COONH4溶液呈中性,不可能是溶液的水解产生的酸碱性影响Mg(OH)2沉淀的溶液。
本题解析:
本题难度:一般
3、填空题 (12分)氧化锌是重要的基础化工原料,从含锌废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)为原料制取ZnO的实验流程如下:
已知几种难溶氢氧化物沉淀的PH范围
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Pb(OH)2 |
| pH | 2.2~3.2 | 5.8~7.9 | 5.5~13.5 | 7.0~13.0 |
参考答案:(1)3Mn2++2MnO4—+2H2O 5MnO2+4H+;Fe(OH)3;
5MnO2+4H+;Fe(OH)3;
(2)Pb;“氧化”时加入的KMnO4的量过多,MnO4—被Zn还原产生MnO2;
(3)ZnCO3·2Zn(OH)2 3ZnO+CO2+2H2O;坩埚和泥三角
3ZnO+CO2+2H2O;坩埚和泥三角
本题解析:根据题给工艺流程和信息知,pH=1的原料废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)加入高锰酸钾溶液氧化,Mn2+被氧化为MnO2,Fe2+被氧化为Fe3+,调pH为5.2,Fe3+转化为氢氧化铁沉淀,经过滤除去氢氧化铁和二氧化锰的混合物;再向滤液中加锌粉,锌与Pb2+发生置换反应生成锌离子和金属铅,,锌与滤液中剩余的高锰酸钾溶液发生氧化还原反应生成二氧化锰;过滤除去铅和二氧化锰,向滤液中加入碳酸钠粉末与Zn2+发生反应生成生成的碱式碳酸锌[ZnCO3·2Zn(OH)2],经过滤、洗涤、灼烧的氧化锌。(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为
3Mn2++2MnO4—+2H2O 5MnO2+4H+;滤渣I的主要成分除MnO2外,另一种是Fe(OH)3; (2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有Pb;滤渣II中含有二氧化锰,其可能原因是“氧化”时加入的KMnO4的量过多,MnO4—被Zn还原产生MnO2; (3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为ZnCO3·2Zn(OH)2
5MnO2+4H+;滤渣I的主要成分除MnO2外,另一种是Fe(OH)3; (2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有Pb;滤渣II中含有二氧化锰,其可能原因是“氧化”时加入的KMnO4的量过多,MnO4—被Zn还原产生MnO2; (3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为ZnCO3·2Zn(OH)2 3ZnO+CO2+2H2O;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是坩埚、玻璃棒、泥三角。
3ZnO+CO2+2H2O;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是坩埚、玻璃棒、泥三角。
考点:以工业废水制备氧化锌的流程为载体考查离子方程式、化学方程式的书写,物质的分离、提纯和化学实验基本操作。
本题难度:一般
4、选择题 已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若向5mL含有KCl和KI各为0.01mol/L的混合溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
参考答案:A
本题解析:在混合溶液中含有各种离子的物质的量为:c(K+)=(0.02mol/L×0.005L)÷0.013L=7.7×10-3mol/L;c(NO3-)=(0.01mol/L×0.008L)÷0.013L=6.15×10-3mol/L;? c(Ag+)=(0.01mol/L×0.008L) ÷0.013L ="6.15" × 10-3mol/L; c(Cl-)=c(I-)="(0.01mol/L×0.005L)" ÷0.013L =3.85×10-3mol/L;由于c(Ag+)·c(I-)= 6.15×10-3mol/L ×3.85×10-3mol/L =2.37×10-6>1.8×10-10 >8.5×10-17,所以首先形成AgI沉淀,二者以1:1关系形成沉淀后,c(Ag+) ·c(Cl-)=(6.15-3.85)×10-3mol/L×3.85×10-3mol/L=8.8610-6>1.8×10-10 =Ksp(AgCl),又形成AgCl沉淀。二者以1:1关系形成沉淀。所以反应后溶液中的离子浓度关系为c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-)。选项为A。
本题难度:一般
5、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。 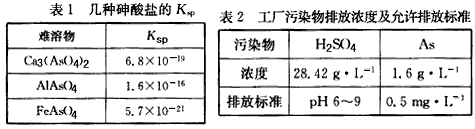
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol/L。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=_________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol/L,c(ASO43-)最大为___________mol/L
(3)工厂排放出的酸性废水中的三价砷(H3ASO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷
(H3AsO4弱酸),写出该反应的离子方程式:__________________。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______________。
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为___________。
参考答案:(1)0. 29
(2)c3(Ca2+)·c2(AsO43-);5.7×10-17
(3)2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
(4)①CaSO4;②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO42-浓度增大,Ca3(AsO4)2开始沉淀
本题解析:
本题难度:一般