时间:2017-09-25 19:24:45
1、填空题 现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知,甲晶体中X与Y的个数比是________,乙中A与B的个数比是________,丙晶胞中有________个C离子,有________个D离子。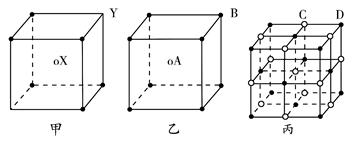
参考答案:4∶3 1∶1 4 4
本题解析:根据均摊规律:甲中体心X为1,顶点Y为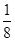 ×6。所以X∶Y=1∶
×6。所以X∶Y=1∶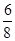 =4∶3。
=4∶3。
同理可计算出乙、丙中微粒个数及其比值。
本题难度:一般
2、选择题 下列关于晶体与非晶体之间的区别的叙错误的是
[? ]
A.化学性质不同
B.物理性质不同
C.外观形状不同
D.微粒状态不同
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列有关液晶的叙述中不正确的是
[ ? ]
A.具有液体的流动性、晶体的各向异性
B.制造液晶显示器
C.不是物质的一种聚集状态
D.液晶分子聚集在一起时,其分子间相互作用很容易受温度、压力和电场的影响
参考答案:C
本题解析:
本题难度:简单
4、计算题 (12分)几何学是解决物质结构问题的基础。C60(每个碳原子与周围3个碳原子相连,如下图)是一系列碳原子簇合物(即富勒烯)的一个典型代表,它的应用十分广泛,涉及光学、信息学、药物学、催化、储氢、超导等。就其结构而言也很特殊。18世纪俄罗斯数学家莱昂哈德·欧拉通过理论论证,明确指出任何一个这样的多面体都必须恰好具有12个五边形方能闭合成多面体。试回答: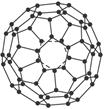
(1)由12个五边形构成的最小碳笼的化学式为__________________________________,计算过程为_________________________。
(2)除碳原子能形成笼形球状分子外,实验中还发现了以金属原子部分取代碳原子的“金属——碳原子”团簇分子,即金属碳烯,若金属碳烯的价电子总数与碳原子团簇分子的价电子总数相等,你认为能代替碳原子的金属有____________________________________(填在周期表中的位置)。
(3)在最小的金属碳烯原子簇化合物中,金属与碳原子个数比为2∶3,这种最小金属碳烯团簇分子的化学式为_____________________________(用M代金属)。
(4)计算机技术的发展带动了理论化学的发展。最近,美国研究人员通过理论计算证明,可以用24个X原子和24个Y原子代替48个碳原子形成C12X24Y24新的团簇分子。若已知这种全非金属团簇分子与C60价电子总数相等,且X、Y、C元素位于同一周期,X的原子半径小于Y的原子半径,则在12个五边形中,每个五边形中有___________个X原子,有___________个Y原子,X是___________元素,Y是___________元素。
(5)目前,化学家已经找到十余种富勒烯家族成员,如C28、C32、C50、C60、C70……(富勒烯家族成员还在增加),它们的分子结构都是由正五边形和正六边形构成的封闭的凸多面体,则C80结构中五边形和六边形的个数分别是_________和_________。
(6)下列物质不属于富勒烯家族的有___________。
A.C18
B.C44
C.C72
D.C83
(7)晶体硼的基本结构单元是由硼原子组成的正二十面体(如下图所示)。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子。请根据观察和计算确定: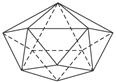
①该基本结构单元内,所含硼原子的个数为__________;所含B—B键的数目是__________。
②若将晶体硼结构单元的每个顶角削去,余下部分就和C60晶体的结构相同。据此确定,C60是由__________个正六边形和__________个正五边形构成。
参考答案:(1)C20? 12×5/3=20
(2)ⅣA或ⅣB的金属?(3)M8C12
(4)2? 2? N? B?(5)12? 30?(6)AD
(7)①12? 30?②12? 20
本题解析:(1)根据“一个碳原子与另三个碳原子相连”的结构特点,很快可以算出由12个五边形构成的最小碳笼分子中含有的碳原子个数为12×5/3=20。(2)价电子数相等,即最外层电子数相等(对同主族元素而言),所以能代替碳原子的金属应是?ⅣA或?ⅣB的金属。(3)因为最小的碳烯原子簇化合物共有20个原子,所以该金属碳烯团簇的化学式为M8C12。(4)因为C12X24Y24与C60价电子总数相等,所以元素X、Y可以有B、N或Be、O或Li、F等多种组合。但是X、Y全是非金属,且原子半径X<Y,所以X是N,Y是B。显然每个五边形中有2个X原子,2个Y原子,1个C原子。(5)由题意知,C80中一定有12个五边形,设C80中六边形的个数为Y,则有(12×5+6Y)/3=80,所以Y=30。(6)富勒烯家族中最小碳原子数为20,所以A不正确;又因为碳原子数必为偶数,所以D也不正确。也可以利用第(5)小题的方法验证B和C选项,其属于富勒烯家族。(7)观?察所给晶体结构示意图,可知在晶体硼中,每个硼原子为5个等边三角形所共有。因此,每个三角形中所含硼原子数目为3× ,该基本结构单元中含硼原子数目为20×
,该基本结构单元中含硼原子数目为20× =12;又因为每条边(B—B键)为2个三角形所共有,因此,该基本结构单元中所含B—B键数目为20×3×
=12;又因为每条边(B—B键)为2个三角形所共有,因此,该基本结构单元中所含B—B键数目为20×3×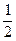 =30。若削去晶体硼结构单元中的一个顶角,则得到一个正五边形(数学上,一个平行于正五棱锥底面的平面与正五棱锥相截,所得截面为一正五边形)。因晶体硼结构单元中每一个顶角都为B原子所占有,晶体硼结构单元中共有12个硼原子,故一共可得12个正五边形。另外,一个等边三角形切去三个顶点后,得到正六边形,因晶体硼结构单元中共有20个等边三角形,故最终将得到20个正六边形。
=30。若削去晶体硼结构单元中的一个顶角,则得到一个正五边形(数学上,一个平行于正五棱锥底面的平面与正五棱锥相截,所得截面为一正五边形)。因晶体硼结构单元中每一个顶角都为B原子所占有,晶体硼结构单元中共有12个硼原子,故一共可得12个正五边形。另外,一个等边三角形切去三个顶点后,得到正六边形,因晶体硼结构单元中共有20个等边三角形,故最终将得到20个正六边形。
本题难度:简单
5、填空题 Ⅰ下列描述中正确的是(?)
A.CS2为V形的极性分子
B.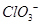 的空间构型为平面三角形
的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和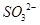 的中心原子均为sp3杂化
的中心原子均为sp3杂化
Ⅱ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,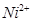 和
和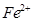 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;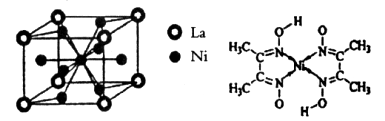
(5)丁二酮肟常用于检验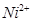 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与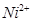 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。
参考答案:(20分)Ⅰ. (6分)C、D?Ⅱ. (14分)(1)[Ar]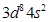 ?(2)>?(3)6,6?
?(2)>?(3)6,6?
(4)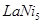 ?(5)①一个σ键、一个π键、配位键?②氢键?③sp2、sp3(每空1分)
?(5)①一个σ键、一个π键、配位键?②氢键?③sp2、sp3(每空1分)
本题解析:Ⅰ.CS2分子中中心原子碳原子含有的孤对电子对数=(4-2×2)÷2=0,所以该分子是直线型结构,属于含有极性键的非极性分子,A不正确;ClO3-中中心原子氯原子含有的孤对电子对数=(7+1-3×2)÷2=1,所以该微粒是三角锥形结构,B不正确;在SF6分子中,S和F形成的是极性键,6个共价键完全是相同,即有6对完全相同的成键电子对,C正确;SiF4和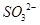 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。
的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。
Ⅱ.(1)Ni的原子序数是28,则根据构造原理可知,Ni原子的核外电子排布式为[Ar]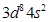 。
。
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。
(3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6。
(4)根据晶胞结构,并依据均摊法可知,晶胞中镧原子数=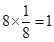 。镍原子数=
。镍原子数=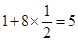 ,所以化学式为LaNi5。
,所以化学式为LaNi5。
(5)①碳和氮形成双键,双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键。
②氧原子与氢原子之间可以形成氢键。
③在该结构中碳原子既有单键又有双键,因此杂化类型是sp2和sp3杂化。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。题时注意电子排布式的书写方法,晶体熔点比较方法,分子空间构型的判断方法以及晶胞的有关计算,注意学习中有关做题方法的积累和总结。
本题难度:一般