时间:2017-09-25 19:24:45
1、填空题 (10分)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的化学方程式?;
CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为?_________________________。
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是?;分子中处于同一直线上的原子数目最多为?。
(3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3,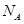 表示阿伏加德罗常数,则立方氮化硼晶胞体积为?cm3。
表示阿伏加德罗常数,则立方氮化硼晶胞体积为?cm3。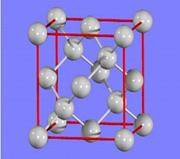
2、填空题 (10分)按下列要求回答:现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘
(1)熔化时不需要破坏化学键的是__________(填序号,下同),熔点最低的是__________。
(2)属于离子化合物的是__________
(3)①的电子式是________________,⑤的电子式是________________。
3、填空题 已知A、B、C、D均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,A原子最外层有3个未成对电子,B原子p能级电子总数与s能级电子总数相等。D是周期表1~18列中的第10列元素。请回答:
(1)C的电子排布图为___________。
(2)A、B两元素的第一电离能较大的是____(填写元素符号)。
(3)A的氢化物的VSEPR模型立体结构为__________。
(4)D属于元素周期表中第____周期____族元素,它的+2价离子的电子排布式为__________。
(5)元素D的氧化物DO晶体结构与NaCl晶体结构相同,已知D2-与最近O2-的核间距离为acm,DO的摩尔质量为M g/mol,若用“NA”表示阿伏加德罗常数, 则DO晶体的密度为_________。
(6)天然的和绝大部分人工制备的晶体都存在各种缺陷,某种DO晶体中就存在如图所示的缺陷:一个
D2+空缺,另有两个D2+被两个D+所取代。其结果晶体仍呈电中性,但化合物中D和O的比值却发生了变化。其氧化D样品组成为D0.97O,则该晶体中D3+与D2+的离子个数比为____。 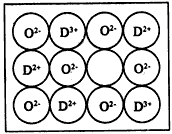
4、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有?(填序号) 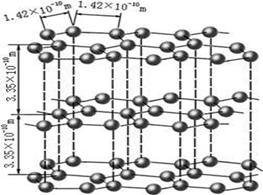
Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
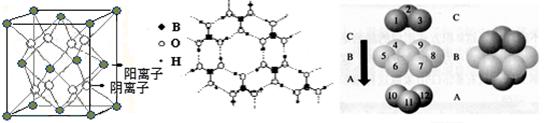
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)  ?
?
图Ⅰ?图Ⅱ?图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为?,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为?;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为?(填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为?
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_?____cm(用代数式表示)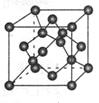
5、选择题 下列与H2O分子空间构型不相同的是
[? ]
A.H2S
B.NH3
C.H2Se
D.CO2