时间:2017-09-25 19:19:49
1、计算题 (8分)接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。某硫酸厂每天排放的1万米3(已换算成标准状况)尾气中含0.2%(体积百分数)的SO2。
(1)若用生石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克生石膏?
(2)若用氨水处理,最少需要标况下的氨气多少升?最多需要标准状况下的氨气多少升?
参考答案:(1)153.6(kg)?(2)最少2×104L?最多4×104L
本题解析:略
本题难度:简单
2、填空题 面粉加工厂的车间里若悬浮着较多的面粉粉尘,遇明火就有发生爆炸的危险。下面是模拟粉尘爆炸的一个实验。如下图,在小塑料筒里放入干燥面粉,点燃蜡烛,用塑料盖盖住金属筒,迅速鼓入大量空气,不久,便会听到“砰”的一声,爆炸的气浪将金属筒上的塑料盖掀起。试问: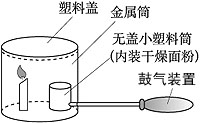
(1)在上述实验中,鼓入空气的作用是______________。
(2)下列情况下,不会发生爆炸的是_______________(填序号)。
①金属筒不加盖时;②蜡烛没有点燃时;③塑料筒中装的是煤粉时。
(3)面粉厂为了避免爆炸事故发生,应采取的安全措施有____________(写出一种即可)。
参考答案:(1)使面粉充满金属筒(2)①②(3)严禁烟火
本题解析:本题考查燃烧的条件、爆炸及易燃易爆物的安全知识。实验中不断的鼓入空气,会把面粉吹起来,使金属筒内充满面粉,一旦遇到明火引起燃烧,就可能发生爆炸。燃烧引起的爆炸是可燃物在有限的空间内燃烧才可能发生,去掉金属盖使空间扩大了,就不容易发生爆炸,而蜡烛没有点燃根本就不会发生爆炸。
本题难度:简单
3、填空题 (14分)青铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)?冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_________(填元素符号)。
(2)?上述冶炼过程产生大量SO2,下列处理方案中合理的是__________(填代号)。
a.?高空排放? b.用于制备硫酸
c.?用纯碱溶液吸收制Na2SO4? d.用浓硫酸吸收
(3)?过二硫酸钾(K2S2O8)具有强氧化性,可将I?氧化为I2:S2O82? + 2I? → 2SO42? + I2;通过改变反应途径,Fe3+、Fe2+均可催化上述反应,试用离子方程式表示Fe3+对上述反应催化的过程:__________、__________。
(4)?利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.?除去Al3+ 的离子方程式是____________________________;
b.?选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸?稀硫酸? KSCN溶液? KMnO4溶液? NaOH溶液?碘水
所选试剂为__________,证明炉渣中含有FeO的实验现象为____________________。
参考答案:(1)? Cu、O? 2分? (2)? b、c? 2分
(3)?①2Fe3+ + 2I? → I2 + 2Fe2+?2分?②2Fe2+ + S2O82? → 2Fe3+ + 2SO42?2分
(4) a.? Al3+ + 4OH? → AlO2? + 2H2O?2分
b.?稀硫酸、KMnO4溶液?2分
用稀硫酸浸取炉渣,所得溶液与酸性KMnO4溶液反应,若溶液褪色则证明存在?2分
本题解析:(1)根据方程式可知,氧气是氧化剂,得到电子,因此被还原的元素是氧元素。CuFeS2中铜元素的化合价是+2价,而生成物中有单质铜生成,所以被还原的元素还有铜。
(2)SO2是一种酸性氧化物,能用于制备硫酸,b正确。SO2还是一种大气污染物,不能随意丢弃,a不正确,c正确。浓硫酸不能稀释SO2,d不正确,答案选bc。
(3)铁离子能把碘离子氧化生成单质碘,而在一定条件下,而S2O82?又能把亚铁离子氧化生成铁离子,方程式为2Fe3+ + 2I? → I2 + 2Fe2+、2Fe2+ + S2O82? → 2Fe3+ + 2SO42?。
(4)①由于氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,所以方程式为Al3+ + 4OH?= AlO2? + 2H2O。
②因为氧化亚铁具有还原性,而酸性高锰酸钾溶液又具有氧化性,亚铁离子能使酸性高锰酸钾溶液褪色,据此可以检验,所以选择的试剂是稀硫酸、KMnO4溶液。实验现象是用稀硫酸浸取炉渣,所得溶液与酸性KMnO4溶液反应,若溶液褪色则证明存在。
本题难度:一般
4、填空题 普通纸张的主要成分是纤维素,在早期的纸张生产中,常采用纸表面涂覆明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存。经分析检验,发现酸性腐蚀主要与造纸中涂覆明矾的工艺有关,其中的化学原理是______;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学方程式为______。
(2)为了保护这些纸质文物,有人建议采取下列措施。
1喷洒碱性溶液,如稀氢氧化钠溶液或氨水等,这样操作产生的主要问题是______。
2喷洒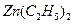 .
.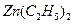 可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。
可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。
(1)?现代造纸工艺常用钛白粉(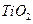 ) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分
) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分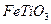 ),为原料按下过程进行的,请
),为原料按下过程进行的,请 完成下列化学方程式
完成下列化学方程式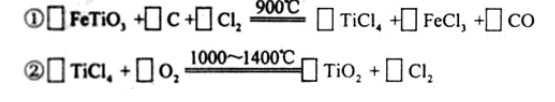
参考答案:
本题解析:略
本题难度:一般
5、选择题 “绿色化学”是一个新概念。在“绿色化学工艺”中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%。在用CH3C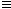 CH合成
CH合成 的过程中,欲使原子利用率达到最高,还需要的其他反应物有
的过程中,欲使原子利用率达到最高,还需要的其他反应物有
[? ]
A.CO和CH3OH
B.CO2和H2O
C.H2和CO2
D.CH3OH和H2?
参考答案:A
本题解析:
本题难度:简单