时间:2017-09-25 19:14:58
1、填空题 铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A和B区域相比较,腐蚀较慢的是 (填字母)。
(2)实验室经常用到FeCl3溶液,在配制FeCl3溶液时常需加入少量 的 ;将FeCl3溶液和碳酸氢钠溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO2):n(CO)=
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时
FeO(s)转化率为50%,则x= 。
参考答案:(1)吸氧腐蚀 A (2) 盐酸 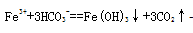 (3)4;1 0.05
(3)4;1 0.05
本题解析:B中接触了水和氧气,更加容易被腐蚀,制备氯化铁加入盐酸主要是防止氯化铁发生水解。衡常数是指在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值,
但需要注意但是固体和纯液体的浓度视为常数,不能出现在表达式中,
c(CO2)
c(CO)
则K=
所以n(CO2):n(CO)=1;4
(3)由于FeO(s)转化率为50%即参与反应的FeO为0.01摩尔,则消耗0.01摩尔一氧化碳,生成0.01摩尔的二氧化碳。所以在 平衡时,氧化亚铁的量为0.01、一氧化碳为X-0.01摩尔,二氧化碳为0.01摩尔,据化学平衡常数计算公式可得0.04=X—0.01即X=0.05摩尔
考点:化学平衡的计算的相关知识点的应用
本题难度:一般
2、选择题 既可以发生消去反应,又能被氧化成醛的物质是( )
A.2-甲基-1-丁醇
B.2,2-二甲基-1-丁醇
C.2-甲基-2-丁醇
D.2,3-二甲基-2-丁醇
参考答案:A
本题解析:
本题难度:简单
3、填空题 (10分)(1)同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4,其中c(NH4+) 由小到大的顺序是 (填序号,下同)。
(2)同浓度的下列溶液:①(NH4)2SO4 ②NH4Cl ③Na2CO3 ④NaHCO3,其中pH 由大到小的顺序是 。
(3)现有下列物质①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡固体⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是 ;
属于弱电解质的是 ;
属于非电解质,但溶于水后的水溶液能导电的是 。
参考答案:(1)③②①(2)③④②①(3)⑦ ③ ②
本题解析:(1)铝离子抑制铵根离子水解,醋酸根离子促进铵根离子水解,铵根离子水解程度越大,则相同浓度的铵盐溶液中铵根离子浓度越小,所以相同浓度的这三种盐,c(NH4+) 由小到大的顺序是③②①,
(2)硫酸铵和氯化铵为强酸弱碱盐,其溶液呈酸性,相同浓度的硫酸铵和氯化铵溶液中,硫酸铵水解程度小于氯化铵,但硫酸铵中铵根离子水解个数多,所以硫酸铵pH最小;碳酸氢钠和碳酸钠溶液都呈碱性,但碳酸根离子水解程度大于碳酸氢根离子,所以相同浓度的碳酸钠和碳酸氢钠,碳酸钠的pH最大,则相同浓度的这四种溶液中,pH由大到小的顺序是③④②①,
(3)有自由移动的电子或自由移动的离子的物质能导电;水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质,完全电离的电解质为强电解质,部分电离的电解质为弱电解质,在上述两种情况下都不能导电的化合物称为非电解质,SO2、酒精等都是非电解质;单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质,所以属于强电解质且在上述状态下能导电的是⑦; 属于弱电解质的是 ③;属于非电解质,但溶于水后的水溶液能导电的是②。
考点:考查离子浓度的大小比较,PH值的大小比较,电解质、非电解质的概念等知识。
本题难度:一般
4、选择题 把物质的量浓度均为0.1mol·L-1的HA和BOH溶液等体积混合,下列说法错误的是
A.若HA为弱酸,BOH为弱碱,则有C(H+)+C(B+)===C(OH-)+ C(A-)
B.若HA为强酸,BOH为弱碱,则有C(A-)>C(B+) >C(H+) >C(OH-)
C.若HA为弱酸,BOH为强碱,则有C(B+) >C(A-) >C(OH-) >C(H+)
D.若HA为强酸,BOH为强碱,则有C(H+)= C(A-)= C(B+)= C(OH-)=0.1mol·L-1
参考答案:D
本题解析:D项:等体积混合,溶液的体积扩到了二倍,浓度缩小了二倍,故C(H+)= C(A-)= C(B+)= C(OH-)=0.05mol·L-1,故错。故选D。
考点:离子浓度大小的比较 酸碱混合时的定性判断及有关ph的计算
点评:本题考查离子浓度的大小比较,题目难度中等,解答该题的关键是根据溶液的pH和溶液中氢离子与氢氧根离子判断电解质的强弱,结合盐类水解的原理可解答该题。
本题难度:困难
5、填空题 (7分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A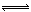 H++HA- HA-
H++HA- HA-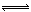 H++A2-
H++A2-
已知相同浓度时的电离程度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) c(H+)最大的是
(2)在0.01mol.L-1的NaHA溶液中2C(A2- )+(C(HA-)+C C(OH-)-C(H+)=
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显 性原因
(用离子方程式表示)
参考答案:(1) A (2分) (2)2C(A2 )+(C(HA )+C C(OH )-C(H+)=( 0.01mol.L-1(2分))
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显 碱 性原因(1分)
(用离子方程式表示)A2-+H2O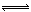 HA- +OH-则原气体中肯定(2分)
HA- +OH-则原气体中肯定(2分)
本题解析:略
本题难度:一般