时间:2017-09-25 18:54:29
1、选择题 下列各组物质间,不能发生反应的是
A.二氧化硅与氧化钙(高温)
B.二氧化硅与氢氧化钠(常温)
C.二氧化硅与碳(高温)
D.二氧化硅与浓硝酸(常温)
参考答案:D
本题解析:在高温下SiO2能被C还原.在众多的酸中能与SiO2反应的只有氢氟酸.
本题难度:一般
2、选择题 某盐的混合溶液中含有0.2mol/L?Na+、0.4mol/L?Mg2+、0.4mol/L?Cl-,则SO42-的浓度为
A.0.1mol/L
B.0.5mol/L
C.0.3mol/L
D.0.15mol/L
参考答案:C
本题解析:分析:根据溶液的电中性计算SO42-的浓度.
解答:溶液呈电中性,根据电荷守恒,则有c(Na+)+2c(Mg2+)+c(H+)=c(Cl-)+2c(SO42-)+c(OH-),
该溶液为强酸和强碱形成的盐溶液,则溶液呈中性,即c(H+)=c(OH-),
所以c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则c(SO42-)=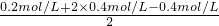 =0.3mol/L,
=0.3mol/L,
故选C.
点评:本题考查溶液离子浓度的计算题目难度不大,利用溶液的电荷守恒计算会起到事半功倍的效果.
本题难度:困难
3、选择题 下列四种溶液:①PH=0的盐酸②0.1mol/L的盐酸③0.01mol/L的NaOH④PH=11的NaOH溶液由水电离生成的氢离子,浓度之比是
A.1:10:100:1000
B.1000:100:10:1
C.14:13:12:11
D.14:13:2:3
参考答案:A
本题解析:试题分析:水是弱电解质,存在电离平衡。酸或碱都是抑制水的电离的,因此①~④中由水电离生成的氢离子浓度(mol/L)分别是10-14、10-13、10-12、10-11,所以它们的浓度之比是1:10:100:1000,答案选A。
考点:考查水的电离平衡以及pH的计算
点评:本题是中等难度的试题,主要是训练学生的灵活运用基础知识的能力,提高学生的应试能力。
本题难度:困难
4、选择题 有四种物质:①金刚石、②白磷、③甲烷、④四氯化碳,其来源:91exam .org中分子具有正四面体构型的是
A.①②③
B.①③④
C.②③④
D.①②③④
参考答案:C
本题解析:金刚石中不存在分子,故有①的都不对,排除后选C。要注意P4(白磷)分子的键角为60°而不是109°28′。
本题难度:困难
5、选择题 下列说法不正确的是
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,2个π键
参考答案:C
本题解析:试题分析:σ键是头对头重贴形成的,π键是肩并肩重贴形成的,所以.σ键比π键重叠程度大,形成的共价键强,A正确;单键都是σ键,双键是由1个σ键,1个π键形成的。三键是由1个σ键,2个π键构成的,所以选项BD正确,C不正确,例如稀有气体分子中不存在化学键,答案选C。
考点:考查σ键、π键的有关判断和应用
点评:该题是高考中的常见考点,属于基础性试题的考查。试题紧扣教材,基础性强。主要是考查学生对σ键、π键的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力的培养。
本题难度:简单