时间:2017-09-25 18:52:40
1、选择题 下列有关说法正确的是 ( )
A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0
B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应
C.为保护海轮的船壳,常在船壳上镶入锌块
D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动
参考答案:C
本题解析:A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,根据ΔG=ΔH-TΔS<0,说明该反应的ΔH<0;B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是吸热反应,不是放热反应; C.为保护海轮的船壳,常在船壳上镶入锌块,锌块与船壳构成原电池的两极,锌块为阳极,保护阴极船壳; D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+是阳离子,向阴极移动。
考点:反应的自发性、水解原理、金属的电化学保护、电解原理综合。
本题难度:一般
2、填空题 现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________。
(2)④、⑤、⑥、⑦四种溶液中 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④按体积比1
参考答案:
本题解析:
本题难度:一般
3、选择题 下列能正确表示水解的离子方程式是
A.CH3COOH + H2O 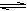 CH3COO- + H3O+
CH3COO- + H3O+
B.NH4+ + H2O 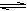 NH3·H2O + H+
NH3·H2O + H+
C.CO32- + 2H2O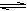 H2CO3 + 2OH-
H2CO3 + 2OH-
D.Br- + H2O 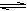 HBr + OH-
HBr + OH-
参考答案:B
本题解析:A、是醋酸电离的方程式,错误;B、是铵根离子水解的方程式,正确;C、碳酸是二元弱酸,水解时是分步进行的,以第一步水解为主,应该是:CO32- + H2O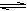 HCO3- + OH-,错误;D、溴离子不会发生水解,错误。
HCO3- + OH-,错误;D、溴离子不会发生水解,错误。
考点:考查离子的水解。
本题难度:一般
4、选择题 下列说法正确的是( )
A.SiO2是酸性氧化物, 不与任何酸反应
B.物质的量浓度相同的Na2SiO3和Na2CO3溶液,其pH值前者大于后者
C.可以用加热的方法除去NaCl中的NH4Cl
D.用pH试纸测得新制氯水的pH为2
参考答案:BC
本题解析:A.SiO2不是酸性氧化物, 能与任何氢氟酸反应,A错误;B.硅酸钠的水解程度大于碳酸钠的水解程度,因此物质的量浓度相同的Na2SiO3和Na2CO3溶液,其pH值前者大于后者,B正确;C.氯化铵受热易分解生成氨气和氯化氢,因此可以用加热的方法除去NaCl中的NH4Cl,C正确;D.新制氯水具有强氧化性,不能用pH试纸测得新制氯水的pH,应该用pH计,D错误,答案选BC。
考点:考查二氧化硅的性质、盐类水解、物质除杂以及氯水的性质等
本题难度:一般
5、选择题 常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L
参考答案:C
本题解析:试题分析:等体积混合后,溶液的溶质应该为NaY,浓度应该为0.15mol/L,但是最后溶液显碱性,说明发生了水解。A选项错误,由pH值计算得到氢离子的浓度为1×10-9 mol/L,则氢氧根离子的浓度应该为1×10-5 mol/L。B选项由于NaY发生水解,则c(Y-)<c(Na+),错误。C选项正确,此等式为质子守恒。D选项最后溶液体积为原来的两倍,钠离子的浓度应该是原来的一半,则为0.15mol/L。
考点:盐类的水解
点评:本题涉及到了一个难点知识盐类的水解,学生在做题时经常会遇到的问题有离子浓度大小的判断,盐类水解中的三个守恒关系的判定,这些需要学生多加练习,熟能生巧。
本题难度:一般