时间:2017-09-25 18:10:00
1、选择题 室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
A.实验过程中水的电离程度的变化是先减小后增大
B.当溶液呈中性时,反应恰好完全
C.当反应恰好完全时,消耗NaOH溶液10mL
D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+)
参考答案:D
本题解析:当氢氧化钠过量时,抑制水的电离,A不正确;醋酸和氢氧化钠恰好反应时,生成的醋酸钠水解,溶液显碱性,B不正确;由于不能确定水解溶液的浓度,因此不能确定消耗氢氧化钠溶液的体积,C不正确;D中符合电荷守恒,正确,答案选D。
点评:该题属于基础性试题,难度不大。重点考查外界条件对水的电离平衡的影响。溶液中离子浓度大小比较。在比较溶液中离子浓度大小时,关键是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
2、选择题 25℃、101 kPa下,1 mol 氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) = 2H2O(1)△H= ―285.8kJ/mol
B.2H2(g)+ O2(g) = 2H2O(1)△H= +571.6 kJ/mol
C.2H2(g)+O2(g) = 2H2O(g)△H= ―571.6 kJ/mol
D.H2(g)+ 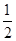 O2(g) = H2O(1)△H= ―285.8kJ/mol
O2(g) = H2O(1)△H= ―285.8kJ/mol
参考答案:D
本题解析:氢气燃烧是放热反应,所以△H小于0,则选项B不正确,D正确。A中燃烧热的数值不正确,C中水的状态不是液态,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练。主要是考查学生对热化学方程式的熟悉掌握程度,以及灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、选择题 物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是(?)
A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>H Y>HX
B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
C. X-、Y-、Z-三种酸根离子均能水解,且水解程度Z->Y->X-
D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(X-)>c(Y-)>c(Z-)
参考答案:BD
本题解析:物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9,根据无弱不水解,有弱就水解,越弱越水解的原则,可以知道HX、HY、HZ三种酸的酸性由强到弱的顺序为HX>HY>HZ,故A错误;NaX的pH为7,所以HX是强酸,HY、HZ是弱酸,所以B正确;X-不能水解,所以C错误;水解程度为Z->Y-,而X-不能水解,所以三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故D正确,所以本题的答案选择BD。
点评:本题考查了盐类的水解,该考点是高考考查的重点和难点,本题有一定的综合性,但是难度适中。
本题难度:简单
4、选择题 向20mL0.5mol L
L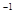 的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是
的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是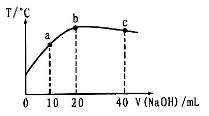
A.醋酸的电离平衡常数:b点>a点
B.由水电离出的c(OH-):b点>a点
C.从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-)
D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:D
本题解析:A、醋酸是弱电解质,在水溶液里存在电离平衡,且其电离过程吸热,温度越高,醋酸的电离程度越大,其电离常数越大,故A正确;B、b点酸碱恰好反应生成醋酸钠,c点氢氧化钠过量,氢氧化钠是强碱抑制水电离,醋酸钠水解促进水电离,所以由水电离出的c(OH-):b点>a点,故B正确;C、如果 c(Na+)=c(CH3COO-),根据电荷守恒知,溶液中c(OH-)=c(H+),醋酸钠是强碱弱酸盐,水解水溶液呈碱性,因此要使其溶液呈中性,则醋酸应该稍微过量,所以从a点到b点,混合溶液中可能存在:c(Na+)=c(CH3COO-),故C正确;D、从b点到c点,氢氧化钠过量,溶液中的溶质是醋酸钠和氢氧化钠,当氢氧化钠的物质的量大于醋酸钠的物质的量时,混合溶液中存在:c(Na+) c(OH-)>>c(CH3COO-)>c(H+),故D错误,答案选D。
本题难度:一般
5、选择题 甲溶液的pH是4,乙溶液的pH是5,则甲溶液与乙溶液的c(OH-)之比为
A.4∶5
B.1∶10
C.10∶1
D.1∶2
参考答案:B
本题解析:
甲溶液与乙溶液的c(OH-)之比为(KW/10―4?):(KW/10―5?)=1:10故B正确。
本题难度:一般