时间:2017-09-25 18:06:23
1、选择题 化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)  ?CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是(?)
?CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是(?)
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应平衡常数表达式:K=
参考答案:A
本题解析:反应达到平衡时,c(Cu2+)和c(Mn2+)不再变化,二者不一定相等,A项错;该反应是沉淀的转移,溶解度小的物质能够转化为溶解度更小的物质,B项正确;加入Cu(NO3)2(s),溶液中的c(Cu2+)增大,平衡向正反应方向移动,c(Mn2+)增大,C项正确;Ksp(MnS)=c(Mn2+)·c(S2-),Ksp(CuS)=c(Cu2+)·c(S2-),所以Ksp(MnS)/Ksp(CuS)=c(Mn2+)/c(Cu2+)=K,D项正确。
本题难度:一般
2、填空题 (12分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有 。
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一 。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: 。
参考答案:(12分) (每空2分)
(1)Ksp=c(Mg2+)·c2(OH-) (2)Mg2+ + 2H2O  Mg(OH)2 +2H+ (3)abc
Mg(OH)2 +2H+ (3)abc
(4)MgCl2·6H2O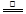 Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O
Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O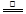 MgO + 2HCl↑+5H2O↑
MgO + 2HCl↑+5H2O↑
(5)HCl气流可抑制Mg2+水解 (6)2Cl
本题解析:
本题难度:一般
3、填空题 (14 分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
?。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。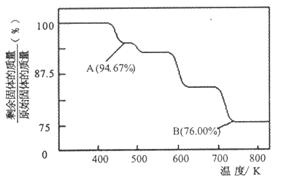
①A 点时剩余固体的成分是?(填化学式)。B 点时剩余固体的成分是?(填化学式)
②从开始加热到 750K时总反应方程式为?。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为?mol·L-1。
参考答案:(14 分)
(1)4CrO3+3C2H5OH+6H2SO4 =2Cr2(SO4)3+3CH3COOH+9H2O(3分)
(2)①Cr3O8(2分)? Cr2O3(2分)② 4CrO3 2Cr2O3+3O2↑(2分)
2Cr2O3+3O2↑(2分)
(3)① 增强溶液的导电性(2分)②3×10-6 (3分)
本题解析:(1)根据题中所提供的反应物和生成物,方程式为4CrO3+3C2H5OH+6H2SO4 =2Cr2(SO4)3+3CH3COOH+9H2O。
(2)①CrO3的热稳定性较差,加热时逐步分解,根据图中所示的情况分析,A 点时剩余固体的成分是Cr3O8,B 点时剩余固体的成分是Cr2O3。
②加热到750K,CrO3分解成Cr2O3,个总方程式为4CrO3 2Cr2O3+3O2↑。
2Cr2O3+3O2↑。
(3)①电解过程中 NaCl 的作用是为了增强溶液的导电性。
②已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31,又知c(Fe3+)为2.0×10-13 mol·L-1,可知c(OH-)为2×10-25,故c(Cr3+)3×10-6。
点评:本题考查的是给与信息的题,学生正确分析透彻题中所给出的信息是解题的关键。题目难度适中。
本题难度:一般
4、填空题 结合下表回答下列问题:
| 物?质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
参考答案:(1)2Fe2++ Cl2 = 2Fe3++ 2Cl-;CuO或Cu(OH) 2或CuCO3;? 4×10-8mol/L
(2)在HCl气氛中蒸发结晶。
本题解析:(1)氯水的氧化性能把二价铁离子氧化成三价铁离子
(2)在HCl气氛中,隔绝了与空气的反应,不容易使杂质介入
本题难度:一般
5、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是

[? ]
参考答案:B
本题解析:
本题难度:一般