时间:2017-09-25 17:48:31
1、选择题 决定主族元素在元素周期表中所处位置的是该元素原子的
[? ]
A.质量数
B.中子数
C.次外层电子数
D.电子层数和最外层电子数
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列物质中酸性最强的是
A.H2SiO3
B.H3PO4
C.H2SO4
D.HClO4
参考答案:D
本题解析:非金属性越强,相应最高价氧化物的水化物的酸性就越强。根据元素周期律可知,非金属性强弱顺序为Cl>S>P>Si,所以答案是D。
本题难度:简单
3、填空题 如图中的实线表示元素周期表的部分边界.①~⑥分别表示元素周期表中对应位置的元素.
(1)请在图中用实线补全元素周期表边界.
(2)元素⑤的原子核外p电子数比s电子总数多______个,元素⑤的原子结构示意图为______.
(3)由元素④和⑥组成的化合物的稀溶液中加入少量二氧化锰粉末,有无色气体生成.则该反应的化学方程式为______.
(4)已知甲元素位于第3周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式______;在一定条件下1g⑥的单质在足量④的单质中完全燃烧生成液态物质时,放出的热量为a kJ,请写出此条件下表示⑥的单质燃烧热的热化学方程式______.
参考答案:根据元素周期表的结构和元素的分布,可推知:①为Na,②为K,③为N,④为O,⑤为F,⑥为H.
(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下: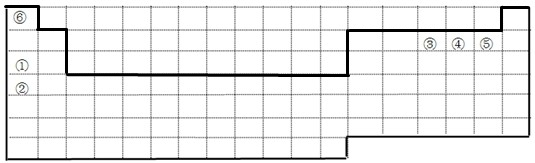 ,
,
故答案为: ;
;
(2)F原子含有9个质子,核外电子排布式为:1s22s22p5,p电子数为5个,s电子数为2+2=4个,因此p电子数比s电子总数多1个;F原子结构示意图为: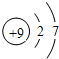 ,故答案为:1;
,故答案为:1;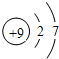 ;
;
(3)由O和H组成的化合物中过氧化氢的稀溶液中加入少量二氧化锰粉末,有氧气生成,化学方程式为:2H2O2 MnO2.2H2O+O2↑,
故答案为:2H2O2 MnO2.2H2O+O2↑;
(4)第三周期金属原子半径最小的为Al,其氧化物氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;1g氢气的物质的量为0.5mol,则1mol氢气氧气中完全燃烧生成液态水,放出热量2akJ,氢气燃烧热的热化学方程式为:H2(g)+12O2(g)=H2O(l)△H=-2aKJ/mol,
故答案为:Al2O3+2OH-=2AlO2-+H2O;H2(g)+12O2(g)=H2O(l)△H=-2aKJ/mol.
本题解析:
本题难度:一般
4、选择题 已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应的水化物酸性依次增强,则下列判断正确的是
[? ]
A.原子半径按X、Y、Z依次增大
B.阴离子的还原性按X、Y、Z顺序增强
C.单质的氧化性按X、Y、Z顺序增强
D.氢化物的稳定性按X、Y、Z顺序减弱
参考答案:C
本题解析:
本题难度:一般
5、选择题 按电负性值依次增大顺序排列的是
A.P S N
B.Li Na K
C.Li B Be
D.S P Si
参考答案:A
本题解析:试题分析:非金属性越强,电负性越大,因此A正确。B不正确,应该是K、Na、Li;C不正确,应该是Li、Be、B;D不正确,应该是Si、P、S,答案选A。
考点:考查电负性大小的判断
点评:该题是基础性试题的考查,试题注重基础,兼顾能力的培养和训练。该题的关键是明确影响电负性大小的因素,然后结合同样灵活运用即可,难度不大,学生不难得分。
本题难度:困难