时间:2017-09-25 17:32:18
1、选择题 现要除去NaCl中少量的CaCl2、Na2SO4杂质,下列选用试剂及其使用顺序正确的是(?)
A.Na2CO3、BaCl2
B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl
D.Ba(NO3)2、Na2CO3、HCl
参考答案:C
本题解析:略
本题难度:简单
2、实验题 (16分)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3·10H2O),为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。
[实验过程]
①按图组装仪器,检查装置的气密性;
②将m1g试样放入硬质玻璃管中,装置B、C、D 中药品如图,己知加药品后装置B的质量为m2 g装置C 的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B 装置中无气泡冒出后,打开活塞a 向装置中通人N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B 的质量为m4g、装置C 的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
⑴装置A中发生反应的化学方程式为____________________________________
⑵装置B的作用为__________________________________________
装置C的作用为________________________________________________
⑶实验过程中通入N2的目的为__________________________________________
⑷用下列各项所提供的数据能计算出ω(NaHCO3)的是____________(填选项字母)。
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | ? m2、m3、 m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
参考答案:⑴2NaHCO3 Na2CO3 + CO2 + H2O (2分)、Na2CO3·10H2O
Na2CO3 + CO2 + H2O (2分)、Na2CO3·10H2O  Na2CO3 + 10 H2O (2分)
Na2CO3 + 10 H2O (2分)
⑵吸收反应生成的水蒸气(2分) ;吸收反应生成的CO2 (2分);
⑶把装置中的CO2和水蒸气排出被装置B和装置C吸收(2分)
⑷b、c 、e? (3分)?;
(5)×100% (3分)
本题解析:(1)装置A中,样品中的NaHCO3受热分解产生CO2、H2O、Na2CO3;Na2CO3·10H2O受热失去结晶水,据此可写出反应方程式。
(2)装置B中的浓硫酸能吸收样品分解产生的水蒸气,装置C中的碱石灰能吸收样品分解产生的CO2。
(3)由于受热分解后,装置中含有CO2、水蒸气,通入N2能将装置中的CO2、H2O排出而被装置C、B吸收,从而降低实验误差。
(4)根据实验原理,样品分解产生的CO2只能被装置c吸收,根据(m5-m3)的质量这个得出分解的NaHCO3的质量,也可得出分解产生的H2O的质量,再根据(m4-m2)的质量并结合NaHCO3分解产生H2O的质量,则可得出Na2CO3·10H2O的质量,为此可得出样品总质量和NaHCO3的质量,从而计算出NaHCO3的质量分数,所以b组数据能计算出NaHCO3质量分数;由m1样品质量和(m2-m4)的质量可得出NaHCO3的质量,从而可计算出NaHCO3的质量分数,故c组数据能计算出NaHCO3质量分数;有m1的样品质量和(m5-m3)的质量可得出NaHCO3的质量,从而可计算出NaHCO3的质量分数,故e组数据能计算出NaHCO3质量分数,但a、d组数据不能计算出NaHCO3质量分数。
(5)选择e组数据计算则与A装置中的水珠无关,根据反应2NaHCO3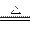 Na2CO3+CO2↑+ H2O,生成CO2的质量=(m5-m3)g,则m1g 样品中NaHCO3的质量=
Na2CO3+CO2↑+ H2O,生成CO2的质量=(m5-m3)g,则m1g 样品中NaHCO3的质量= ,故
,故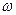 (NaHCO3)=
(NaHCO3)=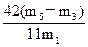 ×100%。
×100%。
本题难度:一般
3、实验题 (16分)溴水和氯化铁溶液均是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。在探究铁的化合物相互转化时,进行下列实验。
实验操作:向足量20 mL的FeSO4溶液中,滴入几滴浓溴水,振荡。
实验现象:溶液由浅绿色变成黄色。
(1)对该实验现象的解释:
①如果发生了化学反应,则使溶液呈黄色的微粒是?(填化学式,下同);
②如果未发生化学反应,则使溶液呈黄色的微粒是?。
(2)通过进一步实验,可证明Br2水和FeSO4溶液是否发生反应。下列是设计的一些实验方案和预测。请填空:
| ? | 操作 | 预期现象及结论 |
| 方案1 | 取少量黄色溶液,加入NaOH溶液 | 如果生成红褐色沉淀,则说明发生了反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 如果溶液变蓝色,则说明未发生反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 如果下层溶液呈橙红色,则说明: ? |
| 实验操作 | 预期现象及结论 | 解释现象的离子方程式 |
| ? | ? | ? 参考答案:(16分) 本题解析:略 本题难度:一般 4、选择题 有一瓶无色气体,可能含有CO2、H2S、HCI、HBr、SO2中的一种或几种。将足量氯水倒入瓶里,振荡,静置得无色透明溶液。将该溶液分为两份:向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份加入稀硝酸酸化的AgNO3溶液,也产生了白色沉淀,.由此可知,正确的结论是 参考答案:D 本题解析:略 本题难度:简单 5、实验题 (12分) 某同学在实验室欲配制物质的量浓度均为1.0 mol/L的NaOH溶液和稀H2SO4各450mL。提供的试剂是:NaOH固体和98%的浓H2SO4(密度为1.84 g/cm3)及蒸馏水。 |
参考答案:
本题解析:略
本题难度:一般