时间:2017-09-25 17:31:36
1、选择题 如图所示为普通锌锰电池(即干电池)的组成和结构示意图,其中MnO2的作用是吸收正极放出的H2,下列说法正确的是( )
A.锌是正极,MnO2是负极
B.锌是负极,MnO2是正极
C.锌是正极,石墨棒是负极
D.锌是负极,石墨棒是正极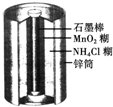
参考答案:普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2,锌是负极,石墨棒是正极.
故选D.
本题解析:
本题难度:一般
2、填空题 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
回答下列问题:
(1)此原电池的正极是石墨?(填“a”或“b”),发生?反应。
(2)电池工作时,盐桥中的SO42-移向?(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲?,乙?。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为?mol。
参考答案:(1)a 还原 (2)乙
(3)MnO4-+5e-+8H+=Mn2++4H2O? 5Fe2+-5e-=5Fe3+
(4)0.5
本题解析:(1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极。(2)电池工作时,SO42-向负极移动,即向乙烧杯移动。(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+。(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol。
本题难度:一般
3、选择题 下列备装置中电流表有电流通过的是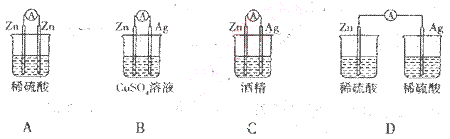 ?
?
参考答案:B
本题解析:A、电极均是Zn,不能形成电流,错误;B、Zn与硫酸铜溶液发生置换反应,且是闭合回路,所以可以形成原电池,有电流通过,正确;C、酒精是非电解质溶液,不能导电,所以没有电流通过,错误;D、未形成闭合回路,不能形成原电池,没有电流通过,错误,答案选B。
本题难度:一般
4、选择题 下列关于铜-锌-稀硫酸构成的原电池的有关叙述,错误的是
[? ]
A.锌做负极,锌发生氧化反应
B.铜做正极,铜不易失去电子而受到保护
C.负极发生还原反应,正极发生氧化反应
D.外电路电子流入的一极为正极,电子流出的一极为负极
参考答案:C
本题解析:
本题难度:简单
5、选择题 据报道,氢燃料电池公交汽车已经驶上北京街头.下列说法正确的是( )
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
D.氢燃料电池汽车的使用可以有效减少城市空气污染
参考答案:A、电解水制取氢气消耗大量的电能,电解水制取氢气是理想而经济的制氢方法,故A错误;
B、氢气密度小,发展氢燃料电池汽车,安全高效的储氢技术是难题,故B错误;
C、氢燃料电池属于原电池,是将化学能转化为电能的装置,故C错误;
D、氢氧燃料电池的生成产物是水,环保无污染,所以氢燃料电池汽车的使用可以有效减少城市空气污染,故D正确.
故选D.
本题解析:
本题难度:简单