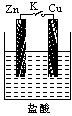时间:2017-09-25 17:31:36
1、选择题 高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是
A.铁是阳极,电极反应为Fe-2e-+2OH- Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
2、选择题 由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为( )
A.3种
B.4种
C.5种
D.6种
3、选择题 称取三份5.6g铁片分别加入装有下列物质的三支试管中:
①50 mL4 mol·L-1 H2SO4;
②50 mL4 mol·L-1 H2SO4+2 g Cu 片;
③50 mL 4 mol·L-1 H2SO4+2 g Cu粉。
则下列关于生成氢气的速率及生成氢气的总量的比较中正确的是
[?]
A.生成氢气的速率:③>②>①,生成氢气的总量:①=②=③?
B.生成氢气的速率:②>③>①,生成氢气的总量:①=②=③?
C.生成氢气的速率:③>②>①,生成氢气的总量:①>②>③?
D.生成氢气的速率和氢气的总量都相等
4、填空题 如图为Zn-Cu原电池的示意图,请回答:
(1)锌片为原电池的______(填“正”或“负”)极,该极的电极反应式是______.该反应属于______(填“氧化”或“还原”)反应.
(2)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从______(填“锌片”或“铜片”)获得电子.
(3)原电池工作一段时间后,H2SO4溶液的浓度______(填“增大”或“减小”,下同),烧杯中溶液的质量______.
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为______L(标准状况).
5、填空题 (1)当K断开时,________上有气泡产生,生成气体对应的离子方程式为__________。
(2)当K闭合时,________片上有气泡。生成气体对应的离子方程式为____________。