时间:2017-09-25 17:12:50
1、填空题 (6分)某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):
cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):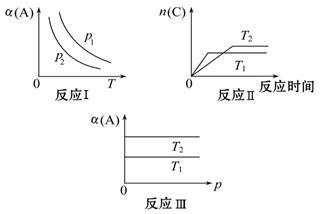
分析图像,回答下列问题:
(1)在图像反应Ⅰ中,若P1<P2(填“>”、“<”或“=”),则此正反应为是一个气体分子数_____(填“减少”或“增大”)的反应,该正反应为_____(填“吸热”或“放热”)反应。由此判断,此反应自发进行的温度是__? ___。(填“低温”“高温”“任何温度”)
(2)在图像反应Ⅱ中,T1_____T2(填“>”、“<”或“=”),该正反应为_____(填“吸热”或“放热”)反应。
(3)在图像反应Ⅲ中,若T1>T2,该反应能否自发进行?
参考答案:(6分)(每空1分)
(1)是一个气体分子数__增大 __
该正反应为_?放热?
自发进行的温度是_?任何温度? _。
(2)反应Ⅱ中,T1___>__T2(填“>”、“<”或“=”),
该正反应为_?放热?(填“吸热”或“放热”)反应。
(3)在图像反应Ⅲ中,能否自发进行?能自发进行
本题解析:略
本题难度:一般
2、填空题 (6分)在一定温度下,将3molA和1molB两种气 体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)
体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g) XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)、X值等于?
(2)、B的平衡浓度为?
(3)、达平衡状态时,A的转化率为? ?
?
(4)、2min内,生成D的平均反应速率为?
(5)、如果增大反应体系的压强,则平衡体系中C的质量分数?(填:“增大” 、“减小” 或“不变” )。
(6)、若升高温度后,D的体积分数减小,则正反应为?(填“放热”或“吸热”)反应。
参考答案:(6分)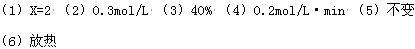
本题解析:略
本题难度:一般
3、填空题 (20分)己知:
(1)2C(石墨s)+O2 (g) =" 2" CO(g)? △H=-222KJ/mol
(g) =" 2" CO(g)? △H=-222KJ/mol
(2)2 H2(g)+O2(g)="2" H2O(g)? △H=-484KJ/mol
(3)C(石墨s)+O2(g)=CO2(g)? △H=-393.5KJ/mo l
l
(4)H2O(g)=H2O(L)? △H=-44KJ/mol
(5)C(金刚石s)+O2(g)=CO2(g)? △H=-395.4KJ/mol
回答下列问题:
(1)C(石墨)的燃烧热为?。
(2)写出表示H2的燃烧热的热化学方程式:? ?。
?。
(3)写出石墨转化为金刚石的热化学方程式(可不注明条件)?。相对更稳定的物质是?。
(4)工业上制H2的一个重要反应是:CO(g)+H2O(g)?CO2 (g)+H2(g)
①该反应的△H=?。
②为了提高CO的转化率,下列措施可采用的是?。
A.升高温度
B.增大压强
C.选择合适的催化剂
D.增大H2O(g)的浓度
③平衡常数K的表达式:K=?。
④800℃时,该反应的平衡常数K=1,则850℃时K?1(填.>、<、=)
⑤800℃时,若起始浓度:C(CO)="1" mol/L, C(H2O)=4mol/L,则达平衡时,C(H2)=?,CO的转化率为?。
参考答案:(20分)
(1)393.5KJ/mol
(2)H2(g)+ O2(g)=H2O(L)? △H=-286KJ/mol
O2(g)=H2O(L)? △H=-286KJ/mol
(3)C(石墨s)=C(金刚石s)? △H="+1.9KJ/mol?" 石墨
(4)①-40.5KJ/mol? ②D? ③K= ? ④<1? ⑤0.8mol/L, 80%
? ④<1? ⑤0.8mol/L, 80%
本题解析:略
本题难度:一般
4、计算题 将等物质的量的A、B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)?+2D(g),经5?min后,测得D的浓度为0.5?mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1?mol/(L
xC(g)?+2D(g),经5?min后,测得D的浓度为0.5?mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1?mol/(L min)。求:
min)。求:
(1)反应开始前放入容器中的A、B的物质的量。
(2)x的值。
(3)B的平均反应速率。
参考答案:(1)3mol
(2)x=2
(3)v(B)=0.05?mol/(L min)?。
min)?。
本题解析:
本题难度:一般
5、计算题 (10分)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应达到平衡后测得c(H?2)=0.008mol/L。求:(1)该反应的平衡常数。
(2)在同样的温度下,该容器中若通入H2和I2(g)各0.20mol,试求达到平衡状态时H2的转化率
参考答案:(1)K=1/4?(2)α(H2)=20%
本题解析:考查可逆反应的有关计算。
(1)根据反应的来源:91考试网 91eXAm.org方程式可知
H2(g)+I2(g) 2HI(g)
2HI(g)
起始量(mol) 0.1? 0.1? 0
转化量(mol) x? x? 2x
平衡量(mol) 0.08? 0.10-x? 2x
所以有 0.10-x=0.08
解得x=0.02mol
所以平衡时氢气、碘和碘化氢的浓度分别是0.008mol/L、0.008mol/L、0.004mol/L
因此平衡常数K=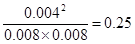
(2)由于反应前后体积不变,所以容器中若通入H2和I2(g)各0.20mol,平衡还是等效的,因此达到平衡状态时H2的转化率不变,仍然是0.02÷0.1=0.2,即20%。
本题难度:一般