时间:2017-09-25 17:04:40
1、填空题 某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下: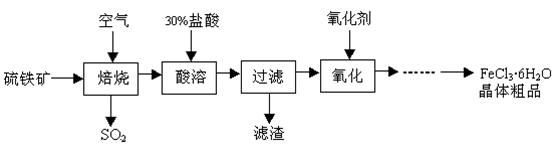
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式?;
(2)“酸溶”中反应的离子方程式为?;
(3)“过滤”后滤液中金属阳离子有?;
(4)“氧化”中使用的氧化剂最好是?;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2②品红③石灰乳 ④O2,用于吸收SO2最好的是?。
参考答案:(1)3FeS2+8O2 Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)?
Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)?
(2)Fe3O4+8H+=2Fe3++Fe2++4H2O;(没配平扣1分,多写其它的离子方程式既不给分也不扣分。)
(3)Fe3+、Fe2+(各1分); (4)Cl2(H2O2等只要合理也可);(5)③
本题解析:(1)由题意可知硫铁矿中铁被氧化成了Fe3O4,可知反应式为3FeS2+8O2 Fe3O4+6SO2 ;
Fe3O4+6SO2 ;
(2)Fe3O4可溶解于盐酸中,反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O ;
(3)由Fe3O4的组成可知铁的化合价为+2和+3;
(4)氧化剂的加入是为了把其中的+2铁氧化成+3,只要不引入杂质即可,如Cl2、O3、H2O2 均可;
(5)吸收尾气SO2 工业上一般用碱性物质,如石灰乳。
本题难度:一般
2、选择题 在含有硝酸铜、硝酸铁、硝酸银各0.1 mol的混合溶液中加入铁粉,充分反应后,析出3.2 g铜,则向溶液中加入的铁粉质量为? ( )
A.5.6 g
B.2.8 g
C.8.4g
D.14 g
参考答案:C
本题解析:由阳离子的氧化顺序可知,铁依次发生如下反应:
Fe+2Ag+=Fe2++2Ag ?2Fe3++Fe=3Fe2+? Fe+Cu2+=Cu+Fe2+
由于最终析出3.2 g铜,也就是说前两个反应已经进行完全,而铜只有一半参加了反应,所以共消耗铁粉为:0.05+0.05+0.05=0.15mol,即共8.4g
答案为C
本题难度:简单
3、计算题 (8分)有Fe和Fe2O3混合物溶于500 mL稀HNO3中,放出2.24 L NO(标准状况),并剩余5.44 g Fe。向反应后的溶液中通入2.016 L Cl2(标准状况),恰好能使溶液中Fe2+全部氧化。求:
(1)稀HNO3物质的量浓度。
(2)混合物中的Fe的质量分数。
参考答案:(1)0.92 mol·L-1? (2)89.99%
本题解析:Fe有剩余,说明稀HNO3量不足,且Fe3+在溶液中一定不存在。溶液中Fe和Fe2O3的存在方式均为Fe(NO3)2。2.016 L÷22.4 L·mol-1="0.09" mol,溶液中铁元素共0.09×2="0.18" mol。在此过程中分析氧化剂和还原剂,由于Fe2O3生成的Fe3+先得Fe单质的电子,又生成Fe2+失电子给Cl2,故整个过程可以看作没有得电子也没有失电子,则该过程中实际转移电子数为:2.24÷22.4×3+0.09×2="0.48" mol,只相当于氧化单质铁,故原混合物中溶解铁为:0.48 mol÷3="0.16" mol,所有的铁再加上剩余的铁。同样硝酸分为作酸和作氧化剂的硝酸。由Fe(NO3)2 0.18 mol求作酸的硝酸,由NO 0.1 mol求作氧化剂的硝酸,两部分相加便是所有的硝酸的量。混合物中Fe2O3同样用所有溶液中铁元素0.18 mol减去溶解的铁单质可求得,再求Fe的含量。
解:(1)Cl2的物质的量:2.016 L÷22.4 L·mol-1="0.09" mol,溶液中Fe(NO3)2物质的量0.09 L·mol-1×2="0.18" mol(铁有剩余,没有Fe3+),作酸的硝酸为:0.18 mol×2="0.36" mol作氧化剂的硝酸为: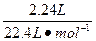 ?="0.1" mol
?="0.1" mol
c(HNO3)=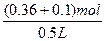 ?="0.92" mol·L-1
?="0.92" mol·L-1
(2)由(1)已知溶液中的铁元素共有0.09×2="0.18" mol,由于Fe2O3生成的Fe3+先得铁单质的电子生成Fe2+,又失电子给Cl2,故整个过程可以看作没有得电子也没有失电子,则该过程中实际转移电子数为2.24 L÷22.4 L·mol-1×3+0.09 mol×2="0.48" mol,只相当于氧化铁单质,故原混合物溶解铁为:0.48 mol÷3="0.16" mol,所有的单质铁为:0.16 mol+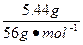 ="0.257" mol
="0.257" mol
Fe2O3中 Fe元素的物质的量:0.18 mol-0.16 mol="0.02" mol。
所以Fe2O3的物质的量为0.01 mol。
Fe的质量分数为: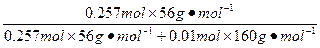 ×100%=89.99%。
×100%=89.99%。
本题难度:简单
4、填空题 (12分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
⑴用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
⑵除去蒸馏水中溶解的O2常采用________的方法。
⑶?生成白色Fe?(OH?)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________。
方法二:如右图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
⑷在试管Ⅰ里加入的试剂是____________。
⑸在试管Ⅱ里加入的试剂是____________。
⑹这样生成的Fe?(OH?)2沉淀能较长时间保持白色,其理由是____________________________。
参考答案:
⑴稀硫酸?铁粉?⑵ 煮沸?⑶ 避免生成的Fe(OH)2沉淀接触空气
⑷稀硫酸?铁粉?⑸? NaOH溶液?
⑹试管Ⅰ中反应生成的H2充满了试管Ⅱ。且外界空气不容易进入
本题解析:(1)还需加入稀硫酸来抑制二价铁离子的水解。以及加入铁粉,使被氧化的二价铁离子还原。(2)一般使用煮沸即可。(3)如果是从液面以上来滴加,液滴会将空气中的氧气带入到溶液中,将二价铁离子氧化。所以需要无氧气的溶液,和伸入液面以下来滴加液体。(4)装置中I为制备硫酸亚铁的装置,使用的试剂为铁和稀硫酸。(5)而装置Ⅱ中加入的是氢氧化钠。(6)在装置I 中既生成了亚硫酸铁,还生成了氢气,排入到装置Ⅱ,防止空气进入。而装置I中加入的稀硫酸和铁粉也能抑制亚铁离子的水解和氧化。
点评:本题属于常规考题,在制备氢氧化铁实验中关键在于抓住防止亚铁离子氧化。
本题难度:一般
5、选择题 20°C时有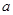 g硫酸铜溶液
g硫酸铜溶液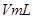 ,将溶液蒸发掉
,将溶液蒸发掉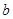 g水后恢复到20°C,恰好全部生成硫酸铜晶体
g水后恢复到20°C,恰好全部生成硫酸铜晶体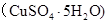 ,则下列关系式错误的是
,则下列关系式错误的是
A.原硫酸铜溶液的密度为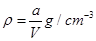
B.原硫酸铜溶液的物质的量浓度为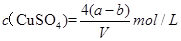
C.原硫酸铜溶液的溶质质量分数为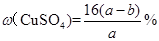
D.生成硫酸铜晶体的物质的量为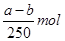
参考答案:C
本题解析:A正确,根据关系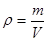 或知,原硫酸铜溶液的密度为
或知,原硫酸铜溶液的密度为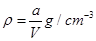
B正确,原溶液中硫酸铜的物质的量量=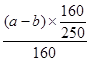 =
=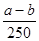 mol,所以原溶液的浓度可得为
mol,所以原溶液的浓度可得为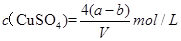
C错,原硫酸铜溶液的溶质质量分数=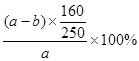
D正确,由铜元素守恒可得:生成硫酸铜晶体的物质的量为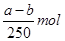
本题难度:一般