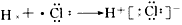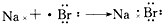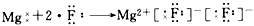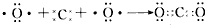1、选择题 下列用电子式表示化合物的形成过程,正确的是
[? ]
A.
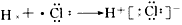
B.
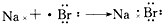
C.
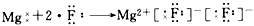
D.
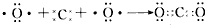
2、填空题 下列为元素周期表中的一部分,除注明外其他都用化学用语回答下列问题:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA |
ⅦA | ?0
?2
?⑥
?⑦
?3
?①
?③
?⑤
⑧
?4
?②
?④
|
(1)8种元素中,化学性质最不活泼的是______;非金属性最强的是______;
(2)①②⑤的最高价氧化物对应水化物的碱性由强到弱的顺序为______;
(3)②③④中形成的简单离子半径由大到小的顺序为______;
(4)⑥的氢化物常温下与元素②的过氧化物反应的离子方程式为______;
(5)①和⑥形成的淡黄色固体的电子式为______,所含化学键的类型为(填“离子键”或“共价键”)______;
(6)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为______.
3、选择题 下列物质变化过程中有共价键明显被破坏的是
[? ]
A.I2升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
4、选择题 下列物质中含有共价键的离子化合物是
[? ]
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦Mg3N2
A.②③④
B.①③④⑦
C.①②④⑦
D.③④⑥
5、填空题 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族
周期 | IA | | 0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
|
(1)写出⑧的原子核外电子排布式______?写出⑤的离子核外电子排布式______
(2)在这些元素中,化学性质最不活泼的是:______(填具体元素符号,下同)
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是______,碱性最强的化合物的电子式是:______;
(4)用电子式表示元素④和⑥的化合物的形成过程:______,此化合物属于______(填“共价”或者“离子”)化合物.
(5)表示①与③的化合物的电子式______,该化合物的共价键类型是______
(6)由③和④按原子个数比1:1形成的化合物的电子式是______;该化合物的化学键类型是______.