时间:2017-09-25 16:46:00
1、选择题 某温度下纯水的 、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
、在此温度下,将pH =8的Ba(OH)2溶液与 PH=5的稀盐酸混合。欲使混合溶液的pH =7,则氢氧化钡溶液与盐酸的体积比为
A.11:1
B.9: 2
C.1:11
D.2:9
参考答案:D
本题解析: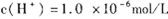 说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,
说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,
酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,
则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,
解得x:y=2:9,
故选D。
点评:本题考查酸碱混合的计算,明确混合后pH=10为碱过量是解答本题的关键,并注意pH与浓度的换算来解答,题目难度不大。
本题难度:一般
2、选择题 下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液加水稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
D.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
参考答案:D
本题解析:醋酸是弱酸,稀释促进电离,A不正确,溶液的pH<4;B不正确,若pH<7,也可能是由于电离程度大于水解程度引起,即H2A也可能是弱酸,B不正确;醋酸是弱酸,所以pH=1的醋酸溶液的浓度大于0.1mol/L,则C中反应后醋酸过量,溶液显酸性,C不正确;D正确,符合电荷守恒定律,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,难易适中,易于调动学生的学习兴趣和学习积极性。该题的关键是明确弱电解质的电离平衡特点,其次利用好电荷守恒和物料守恒等。
本题难度:简单
3、选择题 重晶石(BaSO4)与碳在高温下焙烧可制得BaS。
①BaSO4 (s) + 4C(s) 4CO(g)+BaS(s) △H=+571.2 kJ·mol-1
4CO(g)+BaS(s) △H=+571.2 kJ·mol-1
②BaSO4 (s)+2C(s) 2CO2(g)+BaS(s) △H=+226. 2 kJ·mol-1
2CO2(g)+BaS(s) △H=+226. 2 kJ·mol-1
下列说法中不正确的是
[?]
A.上述反应都是吸热反应
B.反应①中每生成1 mol CO(g)需吸收142.8 kJ热量
C.反应:CO2(g)+C(s)=2CO(g)的△H=+172.5 kJ·mol-1
D.由反应①和②可求得CO的燃烧热△H=-29.7 kJ·mol-1
参考答案:D
本题解析:
本题难度:一般
4、选择题 水的电离平衡曲线如图所示,下列说法不正确的是: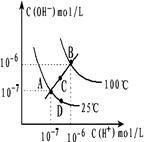
A.图中四点Kw间的关系: A=D<C<B
B.若从A 点到D点,可采用:温度不变在水中加入少量酸
点到D点,可采用:温度不变在水中加入少量酸
C.若从A点到C点,可采用:温度不变在水中加入少量NH4Cl固体
D.若处在B点,将pH=2的硫酸与pH=10的KOH的两种溶液等体积混合后,溶液显中性
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH=?。
(3)丙组实验发生反应的离子方程式为?,
所得溶液中由水电离出的c(OH-) =?mol/L。
参考答案:
本题解析:略
本题难度:一般