时间:2017-09-25 16:46:00
1、选择题 常温下,pH=8~9的Na2SO3溶液中存在:SO32ˉ+H2O HSO3ˉ+OHˉ,下列说法正确的是
HSO3ˉ+OHˉ,下列说法正确的是
A.加入少量NaOH固体,Kw增大
B.c(OHˉ)= c(HSO3ˉ)+2 c(H2SO3)+ c(H+)
C.c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ)
D.加入稀盐酸,c(HSO3ˉ)减小
参考答案:BC
本题解析:水的离子积只与温度有关,与浓度改变引起的平衡移动无关,加入NaOH固体,维持常温不变,Kw不变,故A错误;根据水的电离方程式可知,亚硫酸钠溶液中由水电离出的氢氧根离子浓度一定等于氢离子浓度,根据盐类水解可知,水电离出的氢离子一部分未被消耗,另一部分被亚硫酸根离子消耗,且有如下两种情况:1个亚硫酸根离子消耗1个氢离子变为1个亚硫酸氢根离子、1个亚硫酸根离子消耗2个氢离子变为1个亚硫酸分子,由于微粒数之比等于浓度之比,则水电离出的氢离子浓度=溶液中的氢离子浓度+亚硫酸氢根离子浓度+亚硫酸浓度×2=水电离出的氢氧根离子浓度,故B正确;亚硫酸根离子分两步水解:SO32ˉ+H2O HSO3ˉ+OHˉ、HSO3ˉ+H2O
HSO3ˉ+OHˉ、HSO3ˉ+H2O H2SO3+OHˉ,但是第一步水解程度较弱,第二水解程度更弱,两步水解都生成OHˉ,所以溶液中c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ),故C正确;盐酸与氢氧根离子易反应,能减小氢氧根离子浓度,使亚硫酸根离子的水解平衡右移,则c(HSO3ˉ)增大,故D错误。
H2SO3+OHˉ,但是第一步水解程度较弱,第二水解程度更弱,两步水解都生成OHˉ,所以溶液中c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ),故C正确;盐酸与氢氧根离子易反应,能减小氢氧根离子浓度,使亚硫酸根离子的水解平衡右移,则c(HSO3ˉ)增大,故D错误。
本题难度:简单
2、选择题 某探究小组在某温度下测定溶液的pH值时发现,0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22(mol·L-1)2,则该小组在该温度下测得0.1mol·L-1的NaOH溶液pH值应为(?)
A.13
B.12
C.11
D.10
参考答案:B
本题解析:略
本题难度:简单
3、选择题 室温下,向20.00mL 1.000mol·L-1氨水中滴入1.000mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法错误的是

A.室温下,a点的氨水电离常数为
B.将此氨水稀释,溶液的导电能力减弱
C.c点时消耗盐酸体积V(HCl)<20mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
参考答案:D
本题解析:水的离子积只与温度有关,温度相同水的离子积相同,错误;
本题难度:一般
4、选择题 常温下,强酸溶液A和强碱溶液B的pH之和为15,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是( ?)
A? 1︰10?B 10︰1? C 1︰100?D 100︰1?
参考答案:B
本题解析:常温下,强酸溶液A和强碱溶液B的pH之和为15,可以得到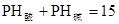 ,带入PH的计算公式可以得到
,带入PH的计算公式可以得到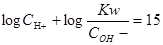 ,整理得到
,整理得到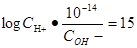 ,
, ,
,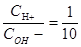 ,要使反应后溶液的PH=7,那么H+和OH-恰好完全反应,二者的物质的量之比为1:1,当物质的量确定是浓度和体积成反比,根据浓度之比为1:10,所以体积之比为10:1,答案选B.
,要使反应后溶液的PH=7,那么H+和OH-恰好完全反应,二者的物质的量之比为1:1,当物质的量确定是浓度和体积成反比,根据浓度之比为1:10,所以体积之比为10:1,答案选B.
本题难度:一般
5、选择题 水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是个吸热过程
参考答案:D
本题解析:35 ℃时水的离子积大于25 ℃时水的离子积,说明35 ℃时水中c(H+)、c(OH-)大于25 ℃时水中c(H+)、c(OH-),但c(H+)仍等于c(OH-);亦说明升高温度,水的电离程度增大,即水的电离是吸热过程。
本题难度:一般