时间:2017-09-25 16:42:23
1、选择题 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
①X元素的原子有二个电子层,处于周期表的第15个纵行 ②Z的原子序数为31,单质常温下为液体 ③气态氢化物水溶液的酸性X<Y<Z ④X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 ⑤Z的原子序数比Y大19,Y的原子序数比X大9.
A.只有②
B.只有①③④⑤
C.只有①②③④
D.全部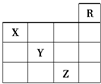
参考答案:B
本题解析:
本题难度:简单
2、选择题 图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
A.非金属性:Y>Z>M
B.离子半径:M->Z2->Y-
C.三种元素中,Y的最高价氧化物对应的水化物酸性最强
D.ZM2分子中各原子的最外层均满足8电子稳定结构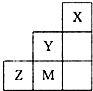
参考答案:由X、Y、Z、M在短周期的相对位置可知,X为氦元素、Y为氟元素、Z为硫元素、M为氯元素.
A、同周期随原子序数增大非金属性增强,非金属性M>Z,同主族自上而下非金属性减弱,非金属性Y>M,所以非金属性Y>M>Z,故A错误;
B、电子排布相同,核电荷数越大离子半径越小,所以离子半径S2->Cl-,最外层电子数相同,电子层越大离子半径越大,所以离子半径,Cl->F-,故离子半径径S2->Cl->F-,故B错误;
C、氟元素没有正化合价,Cl的最高价氧化物对应的水化物酸性最强,故C错误;
D、SCl2分子中氯原子与硫原子之间形成1对共用电子对,硫原子呈2个S-Cl键,分子中各原子的最外层均满足8电子稳定结构,故D正确.
故选:D.
本题解析:
本题难度:简单
3、填空题 (14分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分CH4)为原料经合成气(主要成分CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。
请问答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
(2)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式),CO分子的结构式可表示成 。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体为 晶体。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ,CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
参考答案:(14分)(1)1s2 2s2 2p6 3s 23p6 3d6 4s2(2分)(2) N2(2分)、CN-(2分),C≡O(2分)
(3) 分子晶体(2分)(4) CH4和CH3OH(2分),CH3OH形成分子间氢键(2分)
本题解析:(1)根据构造原理可知,铁原子的基态电子排布式为1s2 2s2 2p6 3s 23p6 3d6 4s2。
(2)应用价电子数和原子数分别都相等的是等电子体,所以与CO分子互为等电子体的分子和离子分别为N2和CN-;由于氮气是直线型结构,所以CO分子的结构式可表示成C≡O。
(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5晶体应该是分子晶体。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子是CH4、CH3OH,CO是直线型结构,采用sp杂化。由于CH3OH形成分子间氢键,所以CH3OH的熔、沸点比CH4的熔、沸点比高。
本题难度:一般
4、选择题 元素在周期中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.由于氟位于周期中表中的第VIIA族,所以HFO也可以称为次氟酸
B.短周期元素形成离子后,最外层都达到8电子稳定结构
C.第三周期元素的最高正化合价等于它所处的主族序数
D.质量数相同的原子,最外层电子数相同,化学性质也相同
参考答案:C
本题解析:
本题难度:一般
5、简答题 下列化学用语书写正确的是( )
A.NH3分子的结构式:
B.CO2分子模型的示意图: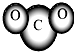
C.乙烯分子的结构简式:CH2CH2
D.Na2O的电子式:
参考答案:A、NH3分子中氮原子最外层5各电子,有三个单电子,与氢原子结合时形成三个共价键,故A正确;
B、二氧化碳分子结构是直线型,选项中的模型中原子的相对位置不对,故B错误;
C、乙烯分子的结构简式中的双键不能省略,故C错误;
D、氧化钠是由钠离子和氧离子构成,电子式的书写两个钠离子不能合并,选项中的电子式不能正确表述得失电子关系,故D错误;
故选A.
本题解析:
本题难度:一般