时间:2017-09-25 16:40:15
1、选择题 常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3?H2O溶液,滴定曲线如下图。下列说法正确的是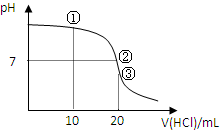
A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+)
B.②溶液:c(NH4+)=c(C1—)>c(OH—)=c(H+)
C.③溶液:c(H+)>c(NH3·H2O) + c(OH—)
D.滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+)
参考答案:BD
本题解析:根据电荷守恒c(C1—)+c(OH—)=c(NH4+)+c(H+)可知,A不正确。②表示溶液显中性,根据电荷守恒可判断,B正确。③表示盐酸和氨水恰好反应,溶液中只有氯化铵,水解显酸性。根据质子守恒可知,c(H+)=c(NH3·H2O) + c(OH—),C不正确。当加入的盐酸很少时,可能出现选项D中的关系,所以答案选BD。
本题难度:一般
2、选择题 下列热化学方程式中的反应热下划线处表示燃烧热的是(?)

参考答案:C
本题解析:
正确答案:C
A、水应为液态;B、燃烧产物为CO2;C、正确;D、可燃物应为1mol
本题难度:一般
3、选择题 常温下,pH=11的NaOH溶液aL分别与下列3种溶液混合,充分反应后使溶液呈中性:
①pH=3的醋酸bL;②物质的量浓度为1×10-3 mol/L的醋酸c L;③ c(OH-)=1×10-11 mol/L的H2SO4的溶液d L。判断a、b、c、d的大小关系,正确的是
A.c>b>a=d B.b>a=d>c C.c>a>d>b D.c>a=d>b |
参考答案:D
本题解析:略
本题难度:简单
4、选择题 用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.盛装标准液的滴定管未用标准液润洗
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡
参考答案:D
本题解析:A.未用标准液润洗碱式滴定管,导致NaOH溶液的浓度偏低,导致消耗NaOH溶液的体积过大,所以最终结果浓度偏高
B.仰视滴定管读数偏高,所以结果偏高
C. 锥形瓶不可润洗,由于盐酸的物质的量多了,所以结果偏高
D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡,说明氢氧化钠读数偏小,所以最终结果浓度偏低。
故选D
点评:掌握中和滴定过程误差分析原理(考虑所消耗的标准溶液体积受到哪些影响)。
本题难度:一般
5、选择题 用标准盐酸滴定未知浓度的NaOH溶液时,测定结果偏高,则产生误差的原因可能是(?)
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,未用盐酸润洗
C.滴定前,滴定管尖端处有气泡,而在滴定后滴定管尖端处气泡消失
D.滴定前仰视读取了酸式滴定管的读数,滴定后读数正确
参考答案:BC
本题解析:略
本题难度:一般