时间:2017-09-25 16:33:56
1、选择题 高炉炼铁的主要反应是:Fe2O3+3CO 2Fe +3CO2。下列说法正确的是(?)
2Fe +3CO2。下列说法正确的是(?)
A.CO2的电子式为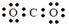
B.Fe2O3分别与浓硝酸和稀硝酸反应,二者产物不同
C.在高炉炼铁过程中,若增加炼铁高炉的高度能提高CO的转化率
D.在高炉炼铁过程中,将铁矿石粉碎后投入高炉可以提高该反应的化学反应速率
参考答案:D
本题解析:A不正确,应该是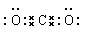 。B不正确,产物都是硝酸铁和水。C不正确,增加炼铁高炉的高度不能提高CO的转化率,增大反应物的接触面积,可以加快反应速率,D正确,答案选D。
。B不正确,产物都是硝酸铁和水。C不正确,增加炼铁高炉的高度不能提高CO的转化率,增大反应物的接触面积,可以加快反应速率,D正确,答案选D。
本题难度:一般
2、填空题 (10分)工业上用CO生产燃料甲醇。一定条件下发生反应: 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
请回答下列问题:
(1)在“图1”中,曲线??(填a或b)表示使用了催化剂;该反应属于??(填吸热、放热)反应。
(2)下列说法正确的是???
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡,v(H2)=???;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为???。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数???(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为???。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数???(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ;ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g)?ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式???。
参考答案:(1)b?放热?(2)C?(3)0.15mol·L-1·min-1? 12?减小
(4) ?
?
(5)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)?ΔH=-280.9kJ/mol
本题解析:(1)使用催化剂降低反应活化能,所以是曲线b,由曲线可看出生成物能量不反应物能量低,反应发热。(2)A:CO起始浓度为1mol/L,容器体积2L,故CO起始量应是2mol;B:增加CO浓度,反应速率增大,但转化率不一定增大;(3)根据反应速率计算公式:V(H2)=C(H2)/△t=1.5mol/10min.L=0.15mol·L-1·min-1zai
平衡常数 ,代入数据即可算的。该反应属于放热反应,故升高温度反应向左移动,平衡常数减小。(4)反应是放热反应,所以升高温度平衡向左移动,甲醇百分数随温度的升高降低;在相同的温度、体积下,压强越大,单位体积反应物浓度越高,正反应速率加快,平衡向右移动,故甲醇百分数较高,P2在P1之上
,代入数据即可算的。该反应属于放热反应,故升高温度反应向左移动,平衡常数减小。(4)反应是放热反应,所以升高温度平衡向左移动,甲醇百分数随温度的升高降低;在相同的温度、体积下,压强越大,单位体积反应物浓度越高,正反应速率加快,平衡向右移动,故甲醇百分数较高,P2在P1之上
点评:综合考查化学平衡章节的内容,熟悉影响化学反应速率及化学平衡的因素及其原理,在此基础上进行推导
本题难度:一般
3、选择题 将固体NH4Br置于密闭容器中,在某温度发生下列可逆反应:
NH4Br(s) NH3(g)+HBr(g);2HBr(g)
NH3(g)+HBr(g);2HBr(g)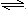 Br2(g)+H2(g).2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用v(NH3)表示,下列反应速率正确的是( )
Br2(g)+H2(g).2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用v(NH3)表示,下列反应速率正确的是( )
A.0.5mol/(L?min)
B.2.5mol/(L?min)
C.2mol/(L?min)
D.5mol/(L?min)
参考答案:B
本题解析:
本题难度:一般
4、填空题 某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
根据图中数据回答下列问题:
(1)该反应的化学方程式为?。
(2)反应开始至2 min,以气体Z表示的平均反应速率为?。
(3)用物质X表示的化学反应速率为0.2 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1 ,哪个快?(?)
,哪个快?(?)
a.前者? b.后者? c.一样快? d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的?倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时??(填“增大”“减小”或“相等”)。?
参考答案:(12分)(1) 3X + Y 2Z [3分] (2)0.2mol?L-1?min-1 [2分]
2Z [3分] (2)0.2mol?L-1?min-1 [2分]
(3) b [2分] (4)0.9[3分] (5)增大[2分]
本题解析:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y? 2Z。(2)在2min时间内,用Z表示反应的平均速率v(Z)=
2Z。(2)在2min时间内,用Z表示反应的平均速率v(Z)= =0.2mol/(L?min)。
=0.2mol/(L?min)。
(3)因为反应速率之比是相应的化学计量数之比,所以如果用物质X表示的化学反应速率为0.2 ,则根据方程式可知,用物质Y表示的反应速率是0.2mol/(L?min)÷3=0.067mol/(L?min)<0.1mol/(L?min),因此后者反应速率快,答案选b。
,则根据方程式可知,用物质Y表示的反应速率是0.2mol/(L?min)÷3=0.067mol/(L?min)<0.1mol/(L?min),因此后者反应速率快,答案选b。
(4)①根据图像可知,平衡时XYZ的物质的量分别是(mol)0.7、0.9和0.2,所以此时体系的压强是开始时的(0.7+0.9+0.2)÷2=0.9倍。
②正方应是体积减小的,而气体的质量不变,所以达平衡时,容器内混合气体的平均相对分子质量比起始投料是增大。
点评:该题是中等难度的试题,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养。答题注意分析各物质的量的变化曲线,把握化学方程式的判断方法。
本题难度:一般
5、选择题 下列说法中正确的是
A.从平衡常数的大小可以推断任意反应进行的程度
B.对同一反应,K值越大,反应的转化率越大
C.K值越大,反应的转化率越小
D.温度越高,K值越大
参考答案:B
本题解析:平衡常数是指当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物能浓度的幂之积的比值。平衡常数只与温度有关,升高温度平衡常数可能增大,也可能减小。平衡常数越大,说明平衡体系中生成物所占的比例越大,它的正向反应进行的程度越大,即该反应进行的越完全,反应物转化率越大。所以正确的答案是B。
本题难度:一般