时间:2017-09-25 16:33:56
1、填空题 (10分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数的值为?。
A(g)+B(g)的平衡常数的值为?。参考答案:(1)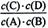 (2)0.022 80% 80%? (3)2.5
(2)0.022 80% 80%? (3)2.5
本题解析:试题分析:(1)该反应平衡常数表达式为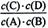 。
。
(2)v(A)=△c(A)/t,A浓度变化为0.003×6=0.018mol/L,所以6s时A的物质的量浓度为(0.04-0.018)mol/L=0.022mol/L;设达到平衡时转化的A的物质的量浓度为xmol/L。
A(g)? +? B(g) C(g)+D(g)
C(g)+D(g)
始(mol/L)0.04? 0.16
平(mol/L)0.04-x? 0.16-x? x? x
830℃时K=1得(0.04-x)(0.16-x) =x·x解得x=0.032。
所以A的转化率为0.032/0.04×100%=80%。若向溶液中再充入氩气,各组分浓度不变,平衡不移动。A的转化率仍为80%。
(3)C(g)+D(g)  A(g)+B(g)与A(g)+B(g)
A(g)+B(g)与A(g)+B(g) C(g)+D(g)平衡常数互为倒数,1200℃时反应C(g)+D(g)
C(g)+D(g)平衡常数互为倒数,1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数K=1/0.4=2.5。
A(g)+B(g)的平衡常数K=1/0.4=2.5。
点评:反应物、生成物互为颠倒,平衡常数互为倒数。
本题难度:一般
2、选择题 重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O  2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入下列哪种试剂,溶液颜色会从黄色逐渐变为橙红色
A.NaHSO4
B.NaHCO3
C.Na2CO3
D.CH3COONa
参考答案:A
本题解析:溶液从黄色变为橙红色,反应逆向进行。A、HSO4–是二元强酸根离子在水溶液中水解能力较大HSO4-=H++SO42-,使溶液中H+浓度增大Cr2O72-(橙红色)+H2O  2H++2CrO42-(黄色)向逆反应方向进行,故溶液逐渐变为橙红色;B、HCO3-在溶液中不易水解HCO3-+H2O
2H++2CrO42-(黄色)向逆反应方向进行,故溶液逐渐变为橙红色;B、HCO3-在溶液中不易水解HCO3-+H2O H2CO3+OH-,H2O
H2CO3+OH-,H2O H++OH-;C、CO32-在水溶液中不易水解,溶液中CO32-+H2O
H++OH-;C、CO32-在水溶液中不易水解,溶液中CO32-+H2O  HCO3?+OH-,H++OH-?
HCO3?+OH-,H++OH-? H2O,反应正向进行;D、CH3COO-+H+
H2O,反应正向进行;D、CH3COO-+H+ CH3COOH,反应正向进行。
CH3COOH,反应正向进行。
本题难度:一般
3、选择题 一定温度和一定体积的条件下反应:A2(s)+2B2(g) 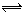 2AB2(g) 达到平衡状态的标志是? (? )
2AB2(g) 达到平衡状态的标志是? (? )
A.V正(B2)==V逆(AB2)
B.容器内的总压强不随时间而变化
C.单位时间内生成1molAB2的同时,消耗1mol的B2
D.气体密度不再随时间变化而变化
参考答案:AD
本题解析:可逆反应达到平衡的标志是正、逆反应速率相等,A正确;因A2是固体,反应前后气体物质的量不变,所以无论是平衡状态还是非平衡状态,温度、体积一定时容器内的压强均不变,B错误;生成AB2和消耗B2均指正反应,无逆反应,C错误;因A2是固体,气体质量不守恒,但气体体积固定不变,所以气体密度不再变化是平衡状态,D正确。
点评:化学平衡状态的标志是正、逆反应速率相等、各组分百分含量保持不变。同时要注意其它的间接标志。
本题难度:简单
4、选择题 在恒温恒容容器中,当下列哪些物理量不再发生变化时,表明A(g) + 2B(g) C(g) + D(g)已达平衡状态:
C(g) + D(g)已达平衡状态:
①混合ν气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥ν(C)与ν(D)的比值⑦混合气体的总质量⑧混合气体的总体积
A.①③④⑤?B.①②③④⑤⑦
C.①③④⑤⑧?D.①②③④⑤⑥⑦⑧
参考答案:A
本题解析:①该反应是一个反应前后气体体积变化的化学反应,反应只有达到平衡状态时,容器中气体的压强才保持不变,所以能证明达到了平衡状态,故正确;②⑦⑧根据质量守恒定律知,反应前后混合物的质量始终不变,容器的体积不变,所以容器内气体的密度始终不变,所以不能证明达到平衡状态,故错误;③④反应到达平衡状态时,平衡时各物质的浓度不变,则各气体的物质的量不变,所以能证明达到平衡状态,故正确;⑤反应是一个反应前后气体体积变化的化学反应,只有达到平衡状态时,气体的总物质的量才不变,反应前后混合物的质量始终不变,此时混合气体的平均相对分子质量,也就不变,所以能证明达到平衡状态,故正确;⑥ν(C)与ν(D)的比值,始终是不变的,所以不能证明达到平衡状态,故错误;故答案A正确
本题难度:一般
5、填空题 反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
⑴若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________?。
⑵若C为气体,且m?+ n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
⑶如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
参考答案:⑴m+n > P ⑵逆?⑶气
本题解析:略
本题难度:一般