时间:2017-09-25 16:27:25
1、选择题 已知下面三个数据:①7.2×10-4②2.6×10-4③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2 NaNO2+HF==HCN+NaF? NaNO2+HF==HNO2+NaF
由此可判断下列叙述中正确的是
[? ]
参考答案:A
本题解析:
本题难度:一般
2、选择题 常温下,对下列四种溶液的叙述正确的是( )
| 编号 | ① | ② | ③ | ④ 溶液 氨水 氢氧化钠溶液 醋酸溶液 盐酸 pH 11 11 3 3 |
参考答案:A.pH=11的氢氧化钠溶液,C(OH-)=10-3 mol/L,C(H+)=10-11 mol/L,pH=3的醋酸溶液,C(H+)=10-3 mol/L,C(OH-)=10-11 mol/L,碱中的氢离子和酸中的氢氧根离子都完全是水电离的,所以②、③溶液中水的电离程度相同,故A错误;
B.强酸或强碱在水中完全电离,弱酸或弱碱在水中都存在电离平衡,所以加水稀释相同的倍数,pH变化最大的是强酸和强碱,所以四种溶液分别加水稀释10倍,pH变化最大的是②和④,故B错误;
C.向①中加入醋酸铵,抑制氨水电离,溶液的pH变小;向②中加入醋酸铵,氢氧化钠和醋酸铵反应,导致氢氧化钠溶液的pH变小,向③中加入醋酸铵,抑制醋酸电离,导致醋酸溶液的pH变大,故C错误;
D.①④两溶液按一定体积比混合,若溶液呈酸性,无论溶液中的溶质是盐酸和氯化铵的混合物还是氯化铵,溶液中氢离子浓度不可能大于氯离子浓度,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列电离方程式错误的是?
A.NaOH=Na++OH-
B.CuSO4=Cu2++SO42-
C.H2SO4=2H++SO42-
D.KMnO4=K++Mn2+-+4O2-
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列说法正确的是
A.明矾水解形成的Al(0H)3胶体能杀菌消毒,可用于水的净化
B.镀锡的铁制品比镀锌的铁制品耐用
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HC1和CH3COOH恰好中和时,消耗NaOH的物质的量相同
参考答 案:D
本题解析:A、明矾水解出的氢氧化铝胶体有吸附性,所以能做净水机,但不能杀菌消毒,所以不选A;B、镀锡铁的镀层破坏后,铁做原电池的负极,腐蚀更快,而镀锌铁的镀层破坏后铁做原电池的正极,仍被保护,所以不选B;C、乙醇是非电解质,乙酸是电解质,所以不选C;D、等物质的量的盐酸和醋酸和氢氧化钠反应,根据方程式,需要的氢氧化钠的物质的量相等,所以选D。
考点:明矾的用途,原电池的应用,电解质的定义,酸碱中和。
本题难度:一般
5、选择题 下列说法正确的是
A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大
B.某溶液中由水电离出的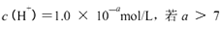 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液
中: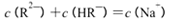
D.相同物质的量浓度的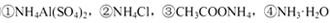 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
参考答案:D
本题解析:A、向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)不变,错误;B、如果该溶液为碱的溶液,水电离出的c(H+)=1.0×10-a mol?L?1,该溶液的pH为a,错误;C、根据电荷守恒可得:c(Na+)+c(H+)=c(OH?)+2c(R2-)+c(HR-),pH等于7,则c(H+)=c(OH?),所以c(Na+)= +2c(R2-)+c(HR-),错误;D、NH4Al(SO4)2中NH4+与Al3+的水解相互抑制,CH3COONH4中CH3COO?与NH4+的水解相互促进,NH3?H2O为弱碱,电离出少量的NH4+,所以c (NH4+)由大到小的顺序是:①>②>③>④,正确。
本题难度:一般