时间:2017-09-25 16:27:25
1、填空题 (4分)物质的量浓度相同的 ① 氨水 ② 氯化铵 ③ 碳酸氢铵 ④ 硫酸氢铵 ⑤ 硫酸铵五种溶液中c(NH4+)大小的顺序是__________________,溶液pH大小的顺序是__________________。
参考答案:⑤④②③①, ①③②⑤④
本题解析:1摩尔硫酸铵能电离出2摩尔铵根离子,所以铵根离子浓度最大,1摩尔硫酸氢铵和碳酸氢铵,氯化铵都能电离出1摩尔铵根离子,在硫酸氢铵中氢离子存在抑制铵根离子水解,碳酸氢根促进铵根水解,所以硫酸氢铵中铵根浓度大于氯化铵大于碳酸氢铵,氨水是弱碱,不能完全电离,所以铵根离子浓度最小。氨水显碱性,碳酸氢铵中双水解,溶液显碱性,硫酸铵中铵根多于氯化铵,水解的铵根离子多,酸性强些,硫酸氢铵电离出氢离子,溶液显酸性,所以pH最小,所以pH的顺序为①③②⑤④
考点:溶液中的离子浓度和pH的比较,
本题难度:一般
2、选择题 由下列实验事实得出的结论正确的是
[? ]
实验事实 结论
A. Cl2的水溶液可以导电 Cl2是电解质
B.在空气中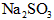 易变质,
易变质,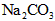 不易变质 酸性:
不易变质 酸性: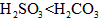
C. C6H5ONa溶液中通CO2气体出现浑浊 酸性: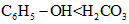
D.常温下白磷可自燃而氮气须在放电时才与氧气反应 非金属性: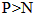
参考答案:C
本题解析:
本题难度:一般
3、选择题 标准状况下,将2.24LNH3通入1L 0.1mol/L的醋酸溶液中,欲确定所得溶液中NH4+、CH3COO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
A.NH3·H2O和CH3COOH的电离常数
B.NH3·H2O和CH3COONH4的电离常数
C.溶液的pH
D.题给反应物的量
参考答案:AC
本题解析:略
本题难度:一般
4、选择题 某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是(?)
A.该温度下,0.31 mol·L-1的HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小
参考答案:A
本题解析:A、电离常数Ka(HF)=3.3×10-4,HF为弱电解质,不能完全电离,25℃时,0.31mol/LHF溶液中c(H+)=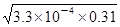 =1×10-2mol/L,pH=1,故A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,故B错误;C、0.31 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L。故C错误;在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,故C不正确。D、向饱和的CaF2溶液中加水后,溶液还可能是饱和的,所以c(Ca2+)不一定比加水前减小,D不正确,答案选A。
=1×10-2mol/L,pH=1,故A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,故B错误;C、0.31 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L。故C错误;在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,故C不正确。D、向饱和的CaF2溶液中加水后,溶液还可能是饱和的,所以c(Ca2+)不一定比加水前减小,D不正确,答案选A。
本题难度:一般
5、简答题 常温下c(H+)=0.1mol/L的两种一元酸HX和HY的溶液各50mL,分别加入足量的镁粉,充分反应后,收集H2的体积为V(HX)和V(HY),若V(HX)>V(HY),则(用“<”“>”或“=”填空):
(1)浓度:c(HX)______c(HY);?酸性强弱:HX______HY;
(2)则开始时生成氢气的速率:v(HX)______v(HY),反应过程中生成氢气的速率:v(HX)______v(HY),反应完毕后溶液中盐的浓度:c(MgX2)______c(MgY2).
参考答案:(1)由H原子守恒知,生成的氢气体积越大,所用酸的物质的量越多,若溶液的体积相同时,酸的物质的量越多,溶液的浓度越大,所以c(HX)>c(HY);?
因为c(HX)>c(HY),两溶液中c(H+)相等,所以HX的电离程度小于HY的电离程度,电离程度越大,酸的酸性越强,所以HX 的酸性小于HY的酸性;
故答案为:>;<;
(2)离子的浓度越大,反应速率越快,刚开始时,氢离子浓度相同,所以反应速率相等;随着反应的进行,氢离子浓度减小,弱酸电离出氢离子补充减少的离子,所以HX 的氢离子浓度大于HY的氢离子浓度,所以反应过程中生成氢气的速率:v(HX)>v(HY);溶液中c(HX)>c(HY),根据氯原子守恒知,与足量镁反应后溶液中盐的浓度
c(MgX2)>c(MgY2),故答案为:═;>;>.
本题解析:
本题难度:一般