时间:2017-09-25 16:27:25
1、选择题 室温下,将1.00mol ? L-1盐酸滴人20. OO mL?1.OOmol ? L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如下图所示。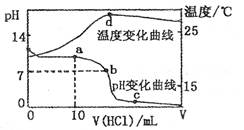
下列有关说法中不正确的是
A.a点溶液中离子浓度大小的关系: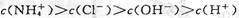
B.b点溶液中离子浓度大小的关系: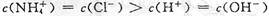
C.c点溶液中离子浓度大小的关系: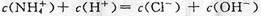
D.d点时溶液温度达到最高,之后温度略有下降,原因是NH3? H2O电离吸热
参考答案:D
本题解析:本题考查溶液中的离子平衡、电解质及中和滴定有关知识。a点溶液中,氨水未完全中和,氨水继续电离,故有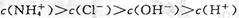 ,A正确;b点溶液显中性有
,A正确;b点溶液显中性有 ,根据电荷守恒有
,根据电荷守恒有 ,且有
,且有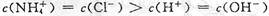 ,B正确;c点溶液中各离子存在电荷守恒,即
,B正确;c点溶液中各离子存在电荷守恒,即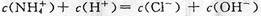 ,C正确;d点时溶液温度达到最高,之后温度略有下降,原因是中和反应已经结束,盐酸温度低,混合后温度降低,D不正确。
,C正确;d点时溶液温度达到最高,之后温度略有下降,原因是中和反应已经结束,盐酸温度低,混合后温度降低,D不正确。
本题难度:一般
2、选择题 以下电离方程式书写正确的是
A. H2S 2H++S2-
2H++S2-
B.CaCO3=Ca2++CO32-
C. NaHCO3 Na++HCO3-
Na++HCO3-
D.NaHS = Na++H++S2-
参考答案:B
本题解析:略
本题难度:一般
3、选择题 有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
[? ]
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1molHY酸,需要的NaOH稍小于1mol
参考答案:D
本题解析:
本题难度:一般
4、选择题 电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )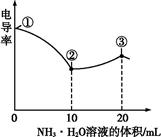
A.①点溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使溶液电导率略降低
参考答案:C
本题解析:①点尚未开始滴定,由于CH3COOH是弱酸,存在电离平衡,此时c(H+)<0.200 mol·L-1,A选项错;由于中和反应为放热反应,随着反应进行溶液温度升高,B选项错;③点时加入20 mL NH3·H2O 溶液恰好把HCl、CH3COOH完全中和,生成等物质的量的NH4Cl与CH3COONH4,由于CH3COO-发生水解,导致其浓度降低,c(Cl-)>c(CH3COO-),C选项正确;③点后,继续滴加氨水,中和反应已进行完全,溶液体积增大造成离子浓度降低,电导率下降,D选项错。
本题难度:一般
5、选择题 有三瓶体积相等,浓度都是1mol·L-1的HCl溶液,分别编号:①、②、③,将①加热蒸发至体积减少一半,在②中加入少量CH3OOONa固体(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液体积是
[? ]
A.①=③>②
B.③>②>①
C.③=②>①
D.①=②=③
参考答案:C
本题解析:
本题难度:一般