时间:2017-09-25 16:22:56
1、简答题 A、B、C、D?4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称______;B在周期表中的位置第______周期,______族;
(2)A、B形成的化合物的电子式______;
(3)C的最高价氧化物的化学式______;
(4)D的最高价氧化物对应的水化物的化学式______.
参考答案:A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;
B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,B的化合价为+5价,原子核外最外层电子数为5,则应为N元素;
C元素原子的最外层电子数比次外层少2个,核外各电子层电子数分别为2、8、6,应为S元素;
C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的最外层电子数为1,位于周期表第四周期,应为K元素,
(1)B为N元素,核外各层电子分别为2、5,应在元素周期表第二周期ⅤA族,故答案为:氮;二,第ⅤA族;
(2)A、B形成的化合物为NH3,为共价化合物,电子式为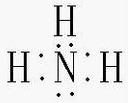
,故答案为: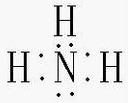
;
(3)C为S元素,S元素最外层电子数为6,则最高正化合价为+6价,则最高价氧化物的化学式为SO3,故答案为:SO3;
(4)D为K元素,其对应的最高价氧化物对应的水化物为KOH,故答案为:KOH.
本题解析:
本题难度:一般
2、选择题 右图为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
| ? | X | |
| ? | Y | ? |
| Z | M | ? |
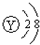
参考答案:根据周期表中短周期结构可知X为氦元素,Y为氟元素,Z为硫元素,M为氯元素.
A、同周期自左而右,非金属性增强,所以非金属性:M>Z;同主族自上而下,非金属性减弱,非金属性:Y>M,故非金属性:Y>M>Z,故A错误;
B、ZM2分子为SCl2,硫原子与氯原子之间形成1对共用电子对,各原子最外层均满足8e-稳定结构,故B正确;
C、同周期自左而右,原子半径减小,所以原子半径Z>M;同主族自上而下,原子半径增大,所以原子半径M>Y,故原子半径Z>M>Y,故C错误;
D、Y为氟元素,其离子核内有9个质子,核外有10电子,离子结构示意图为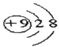
,故D错误.
故选:B.
本题解析:
本题难度:一般
3、填空题 A、B、C、D、E都是短周期元素,原子序数依次增大;A原子中电子运动的轨道只有一种形状;B、C同周期,A、D同主族.D、B能形成两种离子化合物甲和乙,原子个数比分别为2:1和1:1;E元素原子的最外层电子数是其电子总数的
| 1 3 |
| 键类型 | X-X | X=X | X≡X 键能(kJ/mol) 159 418 946 |
参考答案:A、B、C、D、E都是短周期主族元素,原子序数依次增大,A原子中电子运动的轨道只有一种形状,核外只有1个电子,故A为H元素,A、D同主族,与A的原子序数之差大于2,故D为Na元素,D、B能形成两种离子化合物甲和乙,原子个数比分别为2:1和1:1,故B为氧元素,甲为Na2O,乙为Na2O2,B、C同周期,故C为F元素,E元素原子的最外层电子数是其电子总数的13,E处于第三周期,令最外层电子数为x,则10+x=3x,解得x=5,故E为P元素,则
(1)甲为Na2O,乙为Na2O2,含有非极性键的物质是Na2O2,Na2O2的电子式是 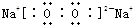
,
故答案为: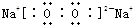
;
(2)非金属性F>P,非金属性越强,氢化物越稳定,故氢化物稳定性为HF>PH3,
故答案为:HF>PH3;
(3)F-与Na+具有相同的电子层结构,核电荷数越大,离子半径越小,故半径较小的是Na+,F-的离子的结构示意图为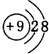
,Na+的离子的结构示意图为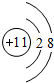
,
?故答案为:Na+,
,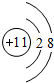
;
(4)B为氧元素,O元素基态原子的轨道表示式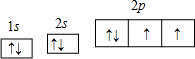
,
故答案为:
;
(5)X是与E同主族的短周期元素,故X为N元素,N-N单键为σ键,键能为159kJ/mol,N=N双键中有1个σ键,1个π键,故N=N双键中π键d键能为418kJ/mol-159kJ/mol=259kJ/mol,N≡N中有1个σ键,2个π键,故N≡N三键中π键的键能为12(946kJ/mol-159kJ/mol)=393.5kJ/mol,键能越大化学键越稳定,故N2中π键比σ键稳定,
故答案为:π键比σ键稳定.
本题解析:
本题难度:一般
4、选择题 主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是aX+<cZ-<bY2-下列说法错误的是( )
A.b一定小于c
B.单质的还原性X>Z
C.Y2-的还原性大于Z?
D.X可位于Y的上一周期、下一周期或同周期
参考答案:A.三种离子的核外电子排布不一定相等,则离子半径cZ-<bY2-,Y、Z可位于同一周期或不同周期,位于同一周期时b小于c,位于不同周期时,b大于c,故A错误;
B.X为金属,易失去电子,Z为非金属性,金属性较弱,则单质的还原性小于X,故B正确;
C.位于同一周期时b小于c,Z的非金属性较强,对应离子的还原性较弱,位于不同周期时,b大于c,仍是Z的非金属性较强,对应离子的还原性较弱,故C正确;
D.离子半径aX+<cZ-<bY2-,处于相同周期时,或X位于Y的上一周期时,aX+<bY2-,X位于Y的下一周期时,核外电子排布相同,核电核数越大,半径越小,则aX+<bY2-,故D正确.
故选A.
本题解析:
本题难度:简单
5、选择题 下列物质中,有离子键的是( )
A.N2
B.CH4
C.NaCl
D.HCl
参考答案:C
本题解析:
本题难度:一般