时间:2017-09-25 16:22:56
1、选择题 下列化学用语表示正确的是( )
A.氧化钙的化学式?CaO2
B.Na2O2的电子式? 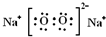
C.乙醇的结构式?CH3CH2OH
D.氯原子的结构示意图? 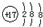
参考答案:B
本题解析:
本题难度:一般
2、简答题 元素周期律和元素周期表对深化物质性质的认识具有重要的作用,有利于将零乱的元素化合物知识整合起来形成知识网络.某同学整理了关于氯元素的相关知识,请你补充完整.
(1)氯元素的原子结构示意图为______,在周期表中的位置为______.
(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为______,氯、溴两种元素的单质中,氧化性强的是______,设计简单的实验方案证明______.
(3)含有氯元素的常见物质转化关系如图: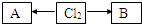 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是______(填化学式).
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是______(填化学式).
参考答案:(1)氯的核电核数为17,原子核外有3个电子层,最外层电子数为7,原子结构示意图为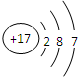 ,位于周期表第三周期、第ⅦA族,
,位于周期表第三周期、第ⅦA族,
故答案为: ;第三周期、第ⅦA族;
;第三周期、第ⅦA族;
(2)非金属性:Cl>S>P,元素的非金属性越强,对应的氢化物的稳定性越强,则稳定性由强到弱的顺序为HCl>H2S>PH3,元素的非金属性越强,单质的氧化性越强,氯、溴两种元素的单质中,氧化性强的是Cl2,可根据单质之间的置换反应证明,为取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2,
故答案为:HCl>H2S>PH3;Cl2;取少量NaBr(HBr)溶液,向其中通入氯气, 91ExaM.org溶液变为橙色,则证明Cl2的氧化性强于Br2;
(3)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,反应的方程式为4HCl(浓)+MnO2△.MnCl2+Cl2↑+2H2O,B具有漂白性,应为HClO,C中氯元素的化合价为最高价,应为HClO4,为酸性最强的无机含氧酸,
故答案为:4HCl(浓)+MnO2△.MnCl2+Cl2↑+2H2O;HClO4.
本题解析:
本题难度:一般
3、填空题 (10分)
(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是 (填“极性”、“非极性”)分子。
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是__________。(填名称)
②A单质和B单质充分反应生成的化合物的电子式是____________。
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子的符号为________。
(3)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。CoCl3·5NH3中Co化合价为?,请写出表示此配合物结构的化学式:?。?
(4)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是
?。
参考答案:(1)极性?(2)①碳?氧?镁?铝? ②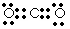 ? ③
? ③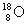
(3)+3? [Co(NH3)5Cl]Cl2?(4)n(A-N+8)/(A+16) mol
本题解析:(1)由于水是极性分子,所以根据相似相溶原理可知,该化合物是极性分子。
(2)①A原子p能级有一个空轨道,所以A是C或Si,由于0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),所以C是金属,因此根据原子序数可知,A是C。B原子的p能级有两个未成对电子,所以B是O。则C是Mg。D离子的半径在B、C、D中为最小,所以D是Al。
②C和O充分反应的生成物是CO2,含有极性键的共价化合物,所以电子式为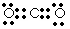 。
。
③1mol单质中含中子的物质的量是20mol,所以1个氧原子中含有10个中子,则符号是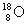 。
。
(3)氯元素的化合价是-1价,所以根据化合价代数和为0可知,Co的化合价是+3价。每1molCoCl3·5NH3只生成2molAgCl,说明只有1个氯离子是配体,所以化学式为 [Co(NH3)5Cl]Cl2 。
(4)核内中子数为N的R2+,质量数为A,则质子数是(A-N),氧化物的化学式是RO,所以ng它的氧化物中所含质子的物质的量是 。
。
本题难度:一般
4、填空题 (1)微粒2311Na+中的质子数是_______,中子数是_______,核外电子数是_______。
(2)用电子式表示下列化合物的形成过程
H2S____________________;MgF2_______________________。
参考答案:(1)11;12;10
(2)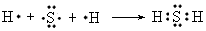
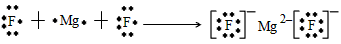
本题解析:
本题难度:一般
5、选择题 下列物质的变化规律,与共价键的键能有关的是
[? ]
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
参考答案:BC
本题解析:
本题难度:一般