时间:2017-09-25 16:18:50
1、选择题 将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g)  ?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
?2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③反应达到平衡时,A、B、C的反应速率一定相等
④反应达到平衡时,A、B、C的物质的量均不再变化
A、①③? B、①④? C、②③? D、③④
参考答案:B
本题解析:考查可逆反应大有关计算,一般采用三段式,即
2A(g)+B(g)  ?2C(g)
?2C(g)
起始量(mol)? 4? 2? 0
转化量(mol)?1.2? 0.6? 1.2
平衡量(mol)? 2.8? 1.4? 1.2
所以用物质A表示的反应的平均速率为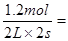 ? 0.3 mol/(L·s)
? 0.3 mol/(L·s)
用物质B表示的反应的平均速率为 ? 0.6 mol/(L·s)
? 0.6 mol/(L·s)
平衡时正逆反应速率相等,各种物质大浓度不再发生变化。但各种物质的反应速率不一定相等,所以正确的答案是B。
本题难度:一般
2、选择题 在一密闭容器中有如下反应:aX(g)+bY(g) nW(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g) ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
其中,w(W)表示W在反应混合物中的体积分数,t表示反应时间。下列分析正确的是( )
A.图Ⅰ可能是不同压强对反应的影响,且p1>p2,a+b<n
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图Ⅱ可能是在同温同压下不同催化剂对反应的影响,且Ⅰ使用的催化剂效果好
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
参考答案:C
本题解析:压强越大,反应速率越快,达到平衡的时间就越短,所以A不正确,应该是P2大于P1。B不正确,若反应是体积体积减小的,则改变压强平衡会方式移动,但图像中反映出的是不移动。所以选项C是正确的。D不正确,如果T1大于T2,则升高温度平衡是向正反应方向移动的,这说明正反应应该是吸热反应,而不是放热反应。答案选C。
本题难度:一般
3、选择题 下列事实不能用勒夏特列原理解释的是
A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好
B.配制FeCl3溶液时,在溶液中加入少量稀盐酸
C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快
D.新制的氯水在光照条件下颜色变浅
参考答案:C
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系。A、碳酸钠水解溶液显碱性,可以用去除油污。水解吸热,因此热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好,适用于勒夏特列原理,A不正确;B、铁离子水解溶液显酸性,所以配制FeCl3溶液时,在溶液中加入少量稀盐酸可以抑制铁离子的水解,适用于勒夏特列原理,B不正确;C、固体反应物的接触面积越大,反应速率越快,与勒夏特列原理无关,C正确;D、在氯水中存在平衡Cl2+H2O HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
HClO+HCl,光照促进次氯酸分解,有利于平衡向正反应方向移动,所以新制的氯水在光照条件下颜色变浅,适用于勒夏特列原理,D不正确,答案选C。
本题难度:一般
4、选择题 相同温度,体积均为0.25L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g) 2XY3(g)
2XY3(g)
△H=-92.6kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示
下列叙述不正确的是
[? ]
A.容器①、②中反应的平衡常数相等
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
D.若容器①体积为0.20L.则达平衡时放出的热量大于46.3kJ
参考答案:C
本题解析:
本题难度:一般
5、选择题 体积比为2∶3的N2和H2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的 ,则N2的转化率为
,则N2的转化率为
A.50%
B.37.5%
C.25%
D.12.5%
参考答案:C
本题解析:略
本题难度:一般