时间:2017-09-24 01:04:12
1、选择题 在任何条件下,纯水显中性,这是因为?(?)
A.PH="7"
B.c(H+)=c(OH-)
C.c(H+)=c(OH-)=10-7mol/L
D.c(H+)×c(OH-)=10-14
参考答案:B
本题解析:略
本题难度:简单
2、计算题 6分)将0.3mol NaCl固体与0.1mol CuSO4?5H2O固体混合溶于水,配成1升混合液。然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解)。求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?所得溶液的PH为多少(假设溶液体积不变)?
参考答案:0.224L;? PH=13
本题解析:考查电解以及pH的有关计算。
氯离子在阳极失去电子,方程式为2Cl――2e-=Cl2↑
共计转移电子是0.3mol÷5=0.06mol
阴极是铜离子放电,方程式为Cu2++2e-=Cu
转移电子是0.1mol÷5×2=0.04mol
所以根据电子得失守恒可知,阴极氢离子得到0.06mol-0.04mol=0.02mol
生成氢气的电极反应式为2H++2e-=H2↑
所以氢气是0.01mol,其标准状况下的体积是0.224L。
同时溶液中生成氢氧化钠是0.01mol×2=0.02mol
浓度是0.02mol÷0.2L=0.1mol/L
PH=13
本题难度:一般
3、选择题 25℃的下列溶液中,碱性最强的是?(?)
A.pH = 11的溶液
B.c(OH-) =" 0.12" mol/L的溶液
C.1L中含有4 g NaOH的溶液
D.c(H+) = 1×10-10 mol/L的溶液
参考答案:B
本题解析:
c(OH-)分别为:A? 10―3mol/L? B? 0.12 mol/L? C? 4g/40g·mol-1=0.1mol/L
D? Kw/1×10-10=10-4 mol/L,?故正确答案:B
本题难度:简单
4、选择题 室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于(?)
M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于(?)
A.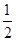 lg(
lg(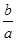 )
)
B.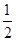 lg(
lg(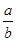 )
)
C.14+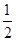 lg(
lg(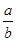 )
)
D.14+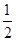 lg(
lg(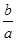 )
)
参考答案:C
本题解析:本题考查溶度积常数及溶液pH的计算,意在考查考生对溶度积常数的理解能力。根据M(OH)2的Ksp=c(M2+)·c2(OH-),则溶液中c(OH-)=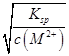 =
=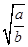 ,则pH=-lg c(H+)=-lg(10-14÷
,则pH=-lg c(H+)=-lg(10-14÷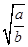 )=-(-14-
)=-(-14-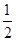 lg
lg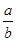 )=14+
)=14+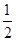 lg
lg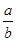 。
。
本题难度:简单
5、选择题 pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是(?)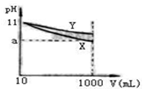
A.X、Y两种碱的物质的量浓度一定相等
B.稀释后,X溶液碱性比Y溶液碱性强
C.若9<a<11,则X、Y都是弱碱
D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
参考答案:C
本题解析:由于稀释可以促进弱电解质的电离,所以对于pH相等的碱溶液,相对弱的碱的pH减小的幅度要小,即酸Y较弱;均稀释到1L时,Y的碱性略强。
由图知两种碱的碱性强弱Y<X,所以pH=11时的两溶液,由c(H+)=c·α公式可知,两碱的物质的量浓度一定不相等;但Y是不是强碱,也不能肯定,如果a=9,则可肯定X为强碱,否则为弱碱
D:由Y的碱性较弱,再由c(H+)=c·α可知Y的c较大,,其物质的量较大,中和时耗盐酸较多
本题难度:一般