时间:2017-09-24 00:55:29
1、填空题
| 族 周期 | IA | 0 1 H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar | ||||||
参考答案:1~18号元素中,有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18,A原子核内仅有1个质子,A为H元素;B原子的最外层电子数为最内层电子数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;D原子有两个电子层,最外层电子数是次外层电子数的3倍,最外层电子数为6,故D为O元素;E元素处于第三周期,E元素的最外层电子数是其电子层数的三分之一,故最外层电子数为2,故E为Mg元素;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,故C的最外层电子数为1+4=5,原子序数小于O元素,故C为N元素,则:
(1)由上述分子可知,A为H元素,B为C元素,C为N元素,D为O元素,E为Mg元素,
故答案为:H,C,N,O,Mg;
(2)H分别与C、N、O所形成化合物的化学式为CH4、NH3、H2O等,
故答案为:CH4、NH3、H2O;
(3)A、C、D形成的化合物与A、D、E形成的化合物间相互反应,故A、C、D形成的化合物为HNO3,A、D、E形成的化合物
为Mg(OH)2,二者发生反应的方程式为:Mg(OH)2+2HNO3=Mg(NO3)2+2H2O,
故答案为:Mg(OH)2+2HNO3=Mg(NO3)2+2H2O.
本题解析:
本题难度:一般
2、选择题 2H、13C、15N、18O、34S等常用作环境分析指示物,下列对它们的说法正确的是
A.34S原子核内的中子数为16?
B.13C和15N原子核内的质子数相差2
C.16O与18O互称同位素?
D.2H的核外电子数比1H多一个
参考答案:C
本题解析:34S原子核内的中子数为18, 13C和15N原子核内的质子数相差1, 2H的核外电子数比1H相等。
本题难度:简单
3、选择题 有甲、乙、丙、丁四种元素,它们的原子序数依次为6、10、11、17。下列判断中错误的是
[? ]
A.丙和丁能形成离子化合物
B.乙和丁的单质不易化合
C.甲的氢化物比丁的氢化物稳定
D.甲和丁能形成共价键
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列各项比较中错误的是( )
A.原子半径:Li<Na<K
B.酸性:H2SiO3<H2CO3<HNO3<HClO4
C.稳定性:SiH4>H2S>HF
D.碱性:NaOH>Mg(OH)2>Be(OH)2
参考答案:A.同主族从上到下原子半径在增大,则原子半径:Li<Na<K,故A正确;
B.非金属性Si<C<N<Cl,则最高价氧化物的酸性为H2SiO3<H2CO3<HNO3<HClO4,故B正确;
C.非金属性F>S>Si,则气态氢化物的稳定性为SiH4<H2S<HF,故C错误;
D.金属性Na>Mg>Be,最高价氧化物的碱性为NaOH>Mg(OH)2>Be(OH)2,故D正确;
故选C.
本题解析:
本题难度:简单
5、填空题 X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如图所示。试回答 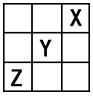
(1)X元素单质的化学式是________。
(2)Y元素的原子结构示意图是___________。
(3)Z元素的名称是____,从元素原子得失电子的角度看,Z元素具有____性;若以Z元素在周期表中所处的位置看,它具有这种性质的原因是__________________。
参考答案:(1)F2
(2) ?
?
(3)砷;非金属和金属(或两性);Z位于周期表中金属和非金属交界处
本题解析:
本题难度:一般