时间:2017-09-24 00:48:04
1、选择题 下列关于电解质溶液的叙述中正确的是(?)
A.Na2CO3、NaHCO3两种盐的溶液中,离子种类是Na2CO3多于NaHCO3
B.在CH3COONa溶液中c (CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.在0.1mol·L-1的醋酸溶液中加入适量的蒸馏水,溶液的c(H+)/c(CH3COOH)增大
D.常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸
参考答案:C
本题解析:A.Na2CO3、NaHCO3两种盐的溶液中,离子种类是Na2CO3和NaHCO3一样多;
B.在CH3COONa溶液中c (CH3COO-) > c(Na+) > c(OH-) > c(H+) ,这样肯定不对,违背了电荷守恒,应该为c(Na+) > c (CH3COO-) >c(OH-) > c(H+);
D.常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,水的电离受到了促进,此溶液为盐溶液,不可能为盐酸。
本题难度:简单
2、选择题 在某温度时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为( )
A.2.4×10-7mol/L
B.1.0×10-7mol/L
C.
| 1.0×10-14 2.4×10-7 |
参考答案:纯水呈中性,则纯水中c(H+)=c(OH-)=2.4×10-7mol/L,故选A.
本题解析:
本题难度:简单
3、填空题 甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法: 。
(3)乙方案中,说明HA是弱电解质的现象是
。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述: 。
参考答案:⑴ 100mL容量瓶(2分)
⑵ >(1分)
取一小段pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在pH试纸中央,对照比色卡,读出溶液的pH(2分)
⑶ 装HA溶液的试管中放出H2的速率快(2分)
⑷ 用蒸馏水配制少量NaA溶液,再测其pH,若pH>7,说明HA是弱电解质 (2分,其他合理答案均可给分)
本题解析:(1)配制的溶液体积为100ml,所以使用100ml容量瓶。
(2)若HA是弱电质,则发生不完全电离,0.1 mol?L?1的HA电离出的H+的浓度小于0.1mol?L?1,pH>1;pH试纸的使用方法回答要点要全面。
(3)配制的两种酸pH相同,加水稀释弱电解质的电离平衡向右移动,弱电解质的H+浓度更大,装HA溶液的试管中放出H2的速率快,可证明HA为弱电解质。
(4)利用盐类的水解,测量NaA溶液的酸碱性可证明HA为弱电解质。
考点:本题考查基本仪器和基本操作、弱电解质的判断方法
本题难度:一般
4、选择题 下列事实不能证明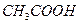 是弱酸的是(?)
是弱酸的是(?)
A.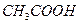 溶液能使石蕊溶液变红
溶液能使石蕊溶液变红
B.0.1 mol/L的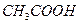 ,H+浓度为0.01mol/L
,H+浓度为0.01mol/L
C.等物质的量浓度的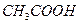 导电能力比盐酸弱
导电能力比盐酸弱
D.0.01mol/L的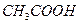 溶液中有两种分子存在
溶液中有两种分子存在
参考答案:A
本题解析:略
本题难度:简单
5、填空题 )2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:
①向曝气池中通入空气的目的是 ?
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是??。
a.Cl-? B.SO42-? C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中b极要连接电的(填“正”或“负”) ?极,C口流出的物质是??。
②SO32-放电的电极反应式为??
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因??。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为??。
(已知:H2S ?Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3? Kal=4.30×10-7;Ka2=5.61 ×10-11)
参考答案:Ⅰ(1)①将H2SO3、HSO3-等氧化为SO42-;?②a?(2)①正?硫酸②SO32- -2e-+H2O=SO42-+2H+;
③ 在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强;
在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强;
Ⅱ? CO32-+H2S=HCO3-+HS-.
本题解析:Ⅰ(2)分析电解池中离子的移动方向,a极连接电源负极,b极连接电源的正极,且b极发生氧化反应,生成硫酸从C口流出,阴极区H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强;Ⅱ用足量的Na2CO3溶液吸收H2S,:H2S ?Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3? Kal=4.30×10-7;Ka2=5.61 ×10-11,可知酸性强弱顺序为H2CO3> H2S >HCO3->HS-,从而反应的离子方程式为CO32-+H2S=HCO3-+HS-.
本题难度:一般