时间:2017-09-24 00:48:04
1、填空题 (7分)下图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线,试回答: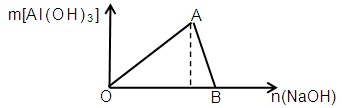
(1) A点时已参加反应的AlCl3和NaOH的物质的量之比是?
(2) OA段曲线所表示的反应的离子方程式是?
(3) AB段曲线所表示的反应的离子方程式是?
(4) B处溶液中存在的浓度最大的离子是?(填离子符号)。向B处于生成的溶液中通入CO2,可见到的现象是?
参考答案:(7分)
⑴ 1:3(1分)
⑵ Al3++3OH-==Al(OH)3↓(2分)
⑶ Al(OH)3+OH―==AlO2-+2H2O (2分)
⑷ Na+ ; 生成白色沉淀(各1分)
本题解析:略
本题难度:一般
2、选择题 下列表述或判断正确的是( )
A.25℃时,pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+)
B.相同条件下等物质的量浓度的①NaCl?溶液;②NaOH溶液;③HCl溶液中由水电离出的c(H+):③>①>②
C.在Na2CO3、NaHCO3两种溶液中,离子种类不相同
D.25℃时,浓度为0.2?mol?L-1的Na2CO3溶液中只存在水解平衡,不存在电离平衡
参考答案:A.相同温度时,相同pH的氢氧化钠和氨水中都存在电荷守恒,c(Na+)+c(H+)=c(NH4+)+c(H+)=c(OH-),溶液的PH相等,则氢离子浓度相等,相同温度时两种溶液中氢氧根离子浓度相等,所以c(Na+)=c(NH4+),故A正确;
B.氢氧化钠和盐酸都抑制水电离,且氢氧化钠和氯化氢都是强电解质,所以等浓度的盐酸和氢氧化钠溶液抑制水电离程度相等,故B错误;
C.碳酸钠溶液中存在CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,碳酸氢钠溶液中存在HCO3-+H2O?H2CO3+OH-、HCO3-?H++CO32-,只要是溶液中都含有氢离子,所以两种溶液中离子种类相同,故C错误;
D.碳酸钠溶液中水是弱电解质,存在电离平衡,碳酸根离子存在水解平衡,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 下列有关电解质的电离和水解说法正确的是(?)
A.在25℃时,任何水溶液中Kw=1×10-14。
B.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
C.在pH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液pH=3
D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大
参考答案:B
本题解析:A.在25℃时,在任何物质的稀的水溶液中存在着Kw=1×10-14。如果浓度较大,就不符合。错误。B.在溶液中H+由H2O和NaHSO4共同电离产生。NaHSO4=Na++H++ SO42-.;H2O H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
本题难度:一般
4、填空题 (5分)常温下,有0.1 mol/L的盐酸和0.1 mol/L的醋酸溶液,回答下列问题:
(1)比较两溶液的pH,盐酸______(填“<”、“=”或“>”)醋酸,
(2)写出醋酸电离的方程式__________。
(3)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为______。
参考答案:⑴<(1分)⑵ CH3COOH CH3COO-+H+ (2分)⑶c(Na+)=c(CH3COO-)>c(H+)=c(OH-) (2分)
CH3COO-+H+ (2分)⑶c(Na+)=c(CH3COO-)>c(H+)=c(OH-) (2分)
本题解析:(1)盐酸是强电解质完全电离,醋酸是弱电解质,不完全电离,所以盐酸中的c(H+)较大,酸性较强,pH较小;(2)醋酸的电离方程式为:CH3COOH CH3COO-+H+(3)根据电荷守恒:c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),溶液显中性故有c(OH-)= c(H+),那么c(CH3COO-)= c(Na+),离子浓度关系为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
CH3COO-+H+(3)根据电荷守恒:c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),溶液显中性故有c(OH-)= c(H+),那么c(CH3COO-)= c(Na+),离子浓度关系为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
考点:强弱电解质的电离和离子浓度的大小比较。
本题难度:一般
5、选择题 下列能正确表示水解的离子方程式是
A.CH3COOH + H2O 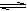 CH3COO- + H3O+
CH3COO- + H3O+
B.NH4+ + H2O 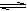 NH3·H2O + H+
NH3·H2O + H+
C.CO32- + 2H2O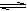 H2CO3 + 2OH-
H2CO3 + 2OH-
D.Br- + H2O 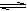 HBr + OH-
HBr + OH-
参考答案:B
本题解析:A、是醋酸电离的方程式,错误;B、是铵根离子水解的方程式,正确;C、碳酸是二元弱酸,水解时是分步进行的,以第一步水解为主,应该是:CO32- + H2O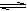 HCO3- + OH-,错误;D、溴离子不会发生水解,错误。
HCO3- + OH-,错误;D、溴离子不会发生水解,错误。
考点:考查离子的水解。
本题难度:一般