时间:2017-09-24 00:40:58
1、选择题 已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
参考答案:B
本题解析:
本题难度:一般
2、选择题 若以w1和w2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
[? ]
A.2w1=w2
B.2w2=w1
C.w2>2w1
D.w1<w2<2w1?
参考答案:C
本题解析:
本题难度:一般
3、填空题 (14分)下列物质中:①NaCl ②Na2O ③CH3COOH ④CO2 ⑤NaHCO3 ⑥NH3·H2O ⑦HCl ⑧NaOH ⑨Cl2 ⑩酒精 请按要求回答下列问题(填编号):
(1) 属于电解质的有 ? ;(2)属于非电解质的有: ? ? ;
(3)属于强电解质的有?;(4)属于弱电解质的有?;
(5)请分别写出NH3·H2O ,NaHCO3的电离方程式:?;???。
参考答案:(共14分)
(1) ①②③⑤⑥⑦⑧?(2)④⑩?(3)①②⑤⑦⑧?(4)③⑥? (各2分)
(5)NH3·H2O 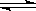 ?NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
?NH4 ++OH-;NaHCO3=Na ++ HCO3-(各3分)
本题解析:(1) 属于电解质的有 ①②③⑤⑥⑦⑧ ;(2)属于非电解质的有:④⑩;
(3)属于强电解质的有①②⑤⑦⑧;(4)属于弱电解质的有③⑥;
(5)NH3·H2O的电离方程式:NH3·H2O 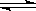 ?NH4 ++OH-;?
?NH4 ++OH-;?
NaHCO3的电离方程式?NaHCO3=Na ++ HCO3-。
点评:水溶液中或熔融状态下能够电离的化合物称为电解质,常见的酸、碱、盐都是电解质如:碳酸、硫酸、硝酸、磷酸、乙酸(醋酸)都是酸,氢氧化钡、一水合氨、氢氧化铜都是碱,碳酸钠、碳酸钙、碳酸氢钠、硫酸铜晶体都是盐,它们都是电解质。在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质。(大多数的有机物都是非电解质)(单质,混合物不管在水溶液中或熔融状态下是否[1]能够导电,都不是电解质或非电解质。)
在水溶液中几乎完全发生电离的电解质叫做强电解质;在水溶液中不完全发生电离的电解质叫做弱电解质。
电解质与非电解质的区别
?
电解质
非电解质
相同点
均为化合物
不同点
水溶液或熔融状态能导电
水溶液和熔融状态都不能导电
本质区别
在水溶液里或熔融状态下自身能发生电离
在水溶液里或熔融状态下自身不能发生电离
所含物质类型
酸, 碱, 盐 , 活泼金属氧化物,水
非金属氧化物,非酸性气态化合物,部分有机物
电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等。凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等。
能导电的化合物不一定是电解质,判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其晶体结构和化学键的性质等因素。例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质。硫酸钡难溶于水,溶液中离子浓度很小,其水溶液不导电,似乎为非电解质。但熔融的硫酸钡却可以导电。因此,硫酸钡是电解质。碳酸钙和硫酸钡具有相类似的情况,也是电解质。从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,但溶的那部分是完全电离的,所以也是电解质。因为溶解是绝对的,不溶是相对的。没有绝对不溶的物质。
本题难度:一般
4、选择题 对于1 L0.1 mol/L氨水的下列说法中,正确的是
A.溶液中的NH3分子是0.1 mol
B.溶液中的NH3·H2O是0.1 mol
C.溶液中的NH3·H2O和NH3共有0.1 mol
D.溶液中的NH3、NH3·H2O、NH4+共有0.1 mol
参考答案:D
本题解析:根据元素守恒,所有含氮元素的微粒之和为0.1 mol/L.
本题难度:简单
5、填空题 H2O2、CH3COOH是生活中常见的物质,在化学研究中应用广泛。
(1)某小组拟在Fe3+的催化下,探究H2O2分解速率影响的某一因素。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
将表中所给的混合溶液分别加入到2个同容积的锥形瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol?L-1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
参考答案:(1)5,探究H2O2的浓度对分解速率影响
(2)不完全;1%(不写百分数扣1分);CH3COOH CH3COO-+H+;慢
CH3COO-+H+;慢
本题解析:据题意可知表1主要探讨H2O2的浓度对分解速率影响,因此加的双氧水的体积为5ml.醋酸属于弱酸,不能完全电离。而电离度(α)= (已电离弱电解质分子数/原弱电解质分子数)*100%,由此可知该温度下醋酸的电离度为1%。取等体积、浓度均为1mol?L-1醋酸和盐酸,弱电解质电离出来的氢离子浓度比盐酸的小,因此与金属反应的反应速率比较慢。
考点:主要考查影响化学反应速率因素以及弱电解质电离的相关知识点。
本题难度:困难