时间:2017-09-24 00:40:18
1、填空题 工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按如下图所示流程制取磷酸、重过磷酸钙[Ca(H2PO4)2]和氢氟酸。图中反应(Ⅰ)为氟磷灰石跟另一种原料反应,生成A、B、C三种物质,其中的产物C又跟氟磷灰石发生反应(Ⅱ),生成B和重过磷酸钙。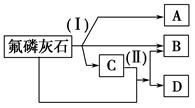
试写出两个反应的化学方程式:反应(Ⅰ)______________;反应(Ⅱ)___ _______
在生产中要特别注意_____________________________________________
参考答案:(Ⅰ)Ca5(PO4)3F+5H2SO4=3H3PO4+5CaSO4+HF↑
(Ⅱ)Ca5(PO4)3F+7H3PO4=5Ca(H2PO4)2+HF↑ 由于HF有毒,因而生产中要特别注意加强劳动保护和防止环境污染
本题解析:解题时,可以把Ca5(PO4)3F看成是Ca3(PO4)2和CaF2的固定组成物,由Ca3(PO4)2、CaF2与浓硫酸的反应化学方程式不难类推出Ca5(PO4)3F与硫酸的反应化学方程式。
本题难度:一般
2、选择题 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器接触室(见图)。按此密闭体系中气体的流向,则在A处流出的气体为(? )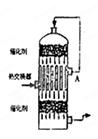
A.SO2
B.SO3、O2
C.SO2、SO3
D.SO2、O2
参考答案:D
本题解析:在接触室里的热交换器是利用前面发生产生的热量给即将发生反应的SO2、O2的混合气体先预热,然后再在催化剂的表面接触氧化,发生反应。因此正确的选项为D。
本题难度:简单
3、选择题 下列工业生产中,关系式不正确的是……( )
A.合成漂白粉:2Cl2---Ca(ClO)2
B.合成H2SO4:FeS2---2H2SO4
C.合成氨:C---H2---2/3 NH3
D.合成HNO3:3NH3---3HNO3
参考答案:C
本题解析:利用守恒法考虑,首先要清楚工业生产这几种物质的反应原理。C中:C+2H2O=CO2+2H2,N2+3H2=2NH3,故C---2H2---4/3NH3
本题难度:一般
4、选择题 近几年,国际上提出了“预防污染”这一概念,“绿色化学”是“预防污染”的根本手段。针对吸烟,下列活动属于“绿色化学”的是
[? ]
A.减少有毒物-------使用过滤嘴、低焦油烟
B.杜绝污染物-------禁烟、戒烟
C.处理废弃物-------烟灰、烟蒂
D.治理污染点-------通风、排出烟雾
参考答案:B
本题解析:
本题难度:简单
5、选择题 2011年7月16日14时25分,中国石油大连石化公司厂区内1000万吨常减压蒸馏装置换热器发生泄漏,引发大火,所幸的是无人员伤亡。下列有关此次事故描述错误的是
A.—个国家化工生产水平常用聚乙烯的产量来衡量
B.本次大火产生的大气污染物可能有二氧化硫、氮氧化物等,应该环保监测
C.事故处理中的消防水全部排入应急池中,避免了对周边海域的污染
D.石油化工生产中常减压蒸馏装置主要是生产轻质油
参考答案:A
本题解析:A错,一个国家化工生产水平的高低通常用乙烯的含量为称量
本题难度:简单