时间:2017-09-24 00:40:18
1、填空题 (2分)海水淡化的方法有多种是?(写出2种)
参考答案:略
本题解析:略
本题难度:简单
2、填空题 (13分)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ?2NH3(g) ?△H=" -92.4" kJ/mol?据此回答以下问题:
?2NH3(g) ?△H=" -92.4" kJ/mol?据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是?(填序号)。
①反应压强为20Mpa~50Mpa?②500℃的高温?③铁触媒作催化剂?④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2?T1(填>、=、<),判断的依据是:?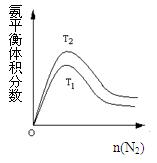
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H
H 2(g)+CO(g) 平衡常数K1
2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g)?平衡常数K2
H2(g)+CO2(g)?平衡常数K2
① K1的表达式:K1=?
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
参考答案:
本题解析:氨气
本题难度:一般
3、选择题 高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用 软锰矿制备高锰酸钾的一种工艺流程。
软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列?(填序号)物质相似。
A.75%酒精
B.双氧水
C.苯酚
D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
?。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:?。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、?和?(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得?mol KMnO4。
参考答案:(1)BD?
(2)2MnO2 + 4KOH + O2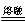 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O
(3)K2MnO4
(4)KOH、MnO2
(5)0.67或
本题解析:略
本题难度:简单
4、选择题 绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是
[? ]
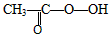 (过氧乙酸)→
(过氧乙酸)→ +CH3COOH
+CH3COOH  +CaCl2+H2O
+CaCl2+H2O
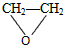


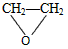 +HOCH2CH2-O-CH2CH2OH+2H2O
+HOCH2CH2-O-CH2CH2OH+2H2O 参考答案:C
本题解析:
本题难度:简单
5、选择题 下列措施符合“绿色化学”思想的是( )
A.直接排放含磷生活污水
B.大量使用氟里昂作为冰箱制冷剂
C.使用可降解塑料代替不可降解塑料
D.使用化学性质稳定、不易分解的有机氯农药
参考答案:C
本题解析:
本题难度:一般