时间:2017-09-24 00:35:53
1、选择题 下列叙述正确的是( )
A.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大
C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等
D.在NaHCO3溶液中:c(OH-)+c(CO32—)=c(H+)+c(H2CO3)
2、选择题 常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
3、选择题 在一定条件下,Na2CO3溶液中存在CO32-+H2O HCO3-+OH-平衡。下列说法不正确的是( )
HCO3-+OH-平衡。下列说法不正确的是( )
A.稀释溶液,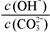 减小
减小
B.加入NaOH固体,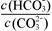 减小
减小
C.升高温度,平衡常数增大
D.通入CO2,溶液pH减小
4、选择题 MOH强碱溶液和等体积、等浓度的HA弱酸混合后,溶液中有关离子浓度的比较正确的是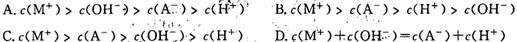
5、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO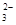 )、c(HCO3?)都减少,其方法是(?)
)、c(HCO3?)都减少,其方法是(?)
A.加入氢氧化钠固体
B.加水
C.通入二氧化碳气体
D.加入饱和石灰水溶液