时间:2017-09-24 00:35:53
1、填空题 以下是25℃时几种难溶电解质的溶解度:
| 难容电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
参考答案:(1)氢氧化铁? (2)氨水
(3)2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3
(4)A、C、D、E
本题解析:①中为了不引入杂质离子,应加入氨水使Fe3+沉淀,而不能用NaOH溶液。②中根据溶解度表可明确Mg(OH)2能较容易转化为Fe(OH)3,因此在MgCl2溶液中加入足量Mg(OH)2可除去Fe3+,然后将沉淀一并过滤。③中利用高价阳离子Fe3+极易水解的特点,据题意可知调节溶液的pH=4可使Fe3+沉淀完全,为了不引入杂质离子,因此可使用CuO、Cu(OH)2、CuCO3等调节溶液的pH。
本题难度:简单
2、选择题 常温下,能使纯水中H+数目增加的是()
A.S2-
B.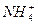
C.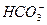
D.Br-
参考答案:B
本题解析:S2-、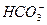 、
、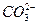 等离子都是结合水中的H+生成弱电解质,从而使水的电离平衡向正反应方向移动,OH-数目增多,显碱性。Br-不使水的电离平衡移动,c(H+)=c(OH-)而显中性,H+数目不增多。只有
等离子都是结合水中的H+生成弱电解质,从而使水的电离平衡向正反应方向移动,OH-数目增多,显碱性。Br-不使水的电离平衡移动,c(H+)=c(OH-)而显中性,H+数目不增多。只有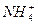 水解显酸性,是因为
水解显酸性,是因为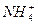 结合了水电离的OH-而使水的电离平衡向电离方向移动,使H+数目增多,浓度增大而显酸性。使溶液中H+数目增多的方法还有升高温度或加入少量盐酸等方法。
结合了水电离的OH-而使水的电离平衡向电离方向移动,使H+数目增多,浓度增大而显酸性。使溶液中H+数目增多的方法还有升高温度或加入少量盐酸等方法。
本题难度:简单
3、选择题 H2A是二元弱酸,KHA溶液呈酸性。在0.1mol·L-1 KHA溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HA-)+c(OH-)+c(A2-)? B.c(HA-)+c(A2-)=0.1mol·L-1
C.c(A2-)>c(H2A)? D.c(K+)=c(H2A)+c(HA-)+c(A2-)
参考答案:CD
本题解析:在0.1mol·L-1 KHA溶液中,根据电荷守恒可以得到,c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),故A错误,根据物料守恒,可以得到c(HA-)+c(A2-)+c(H2A)=0.1mol·L-1,故B错误,因为KHA溶液呈酸性,所以HA-的电离大于水解,故c(A2-)>c(H2A) ,所以C正确,根据物料守恒可以得到c(K+)=c(H2A)+c(HA-)+c(A2-) ,故D正确,所以本题的正确答案选择CD。
点评:本题考查水溶液中的电荷守恒、物料守恒,该知识点是高考考查的重点和难点,本题难度适中。
本题难度:一般
4、选择题 等物质的量浓度的下列溶液中,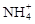 浓度最大的是(?)
浓度最大的是(?)
A.NH4HSO4
B.NH4Cl
C.NH4HCO3
D.NH4NO3
参考答案:A
本题解析:由于硫酸氢铵电离出的氢离子,能抑制NH4+水解,所以NH4+最大,答案选A。
本题难度:一般
5、选择题 在室温下,将等体积的酸溶液和碱溶液混合,其溶液的PH一定大于7的是(? )
A.PH=2的盐酸跟PH=12的氢氧化钠溶液
B.PH=2的醋酸和PH=12的氢氧化钾溶液
C.PH=2的硝酸跟PH=12的氢氧化钡溶液
D.PH=2的硫酸跟PH=12的氨水
参考答案:D
本题解析:A、C恰好中和呈中性;B醋酸过量呈酸性;D氨水过量呈碱性。
本题难度:一般