时间:2017-09-24 00:34:30
1、选择题 A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中AC和BD的盐溶液的pH=7,BC盐溶液pH>7,则下列说法正确的是:
A、AD盐溶液pH>7
B、酸的电离程度一定是HD<HC
C、碱的电离程度一定是AOH>BOH
D、在AC盐溶液中c(A+)+ c(AOH)= c(C-)+ c(HC)
参考答案:D
本题解析:AC和BD的盐溶液的pH=7,BC盐溶液pH>7,这说明C—一定水解,因此A+也水解,且二者的水解程度相同。B+、D—均不水解。则A、AD盐溶液中A+水解,溶液显酸性,则pH<7,A错误;B、根据以上分析可知酸的电离程度一定是HD>HC,B错误;C、根据以上分析可知碱的电离程度一定是AOH<BOH,C错误;D、在AC盐溶液中根据物料守恒可知c(A+)+ c(AOH)= c(C-)+ c(HC),D正确,答案选D。
考点:考查盐类水解的应用
本题难度:一般
2、填空题 (7分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A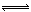 H++HA- HA-
H++HA- HA-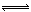 H++A2-
H++A2-
已知相同浓度时的电离程度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) c(H+)最大的是
(2)在0.01mol.L-1的NaHA溶液中2C(A2- )+(C(HA-)+C C(OH-)-C(H+)=
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显 性原因
(用离子方程式表示)
参考答案:(1) A (2分) (2)2C(A2 )+(C(HA )+C C(OH )-C(H+)=( 0.01mol.L-1(2分))
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显 碱 性原因(1分)
(用离子方程式表示)A2-+H2O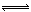 HA- +OH-则原气体中肯定(2分)
HA- +OH-则原气体中肯定(2分)
本题解析:略
本题难度:一般
3、填空题 已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
B.c (CH3COO-)>c (Na +)>c (OH-)>c (H+)
C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-)
D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+)
(1)这四组关系中有一组是不可能的,这组关系是 (选填序号)。
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(3)若上述关系中C是正确的,则溶液中溶质的化学式是 。
(4)若该溶液由体积相等的醋酸和NaOH溶液混合而成,且恰好呈中性,则:
混合前c(CH3COOH) c(NaOH)(填“>”、“<”、或“=”,下同);
混合后溶液中c(Na+) c(CH3COO-)。
参考答案:(1)B ;
(2)D;
(3)CH3COOH和CH3COONa ;
(4)> ; =。
本题解析:
试题分析:(1) B中不符合电荷守恒
(2)当溶液中只有一种溶质是必须为醋酸钠,则醋酸钠溶液中各离子浓度大小顺序为c (Na+)>c(CH3COO-)>c (OH-)>c (H+),因为醋酸根离子是弱酸根,会水解。
(3)因为溶液为酸性,所以存在醋酸,酸性溶液中不可能是氢氧化钠,所以只能是醋酸钠;
(4) 因为醋酸是弱酸,弱电解质,不能完全电离,而溶液体积相等,当恰好中和时,c(CH3COOH)>c(NaOH);因为恰好呈中性,氢离子与氢氧根离子的物质的量浓度恰好相等,因为电荷守恒,所以c(Na+)=c(CH3COO-)
考点:考查离子。
本题难度:困难
4、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
A.c(K+) + c(H+) = c(S2—) + c(HS—) + c(OH—)
B.c(K+) + c(S2—) = 0.3mol/L
C.c(K+) = c(S2—) + c(HS—) + c(H2S)
D.c(OH—) = c(H+) + c(HS—) + 2c(H2S)
参考答案:D
本题解析:A 错误,电荷守恒,c(S2—) 应为2c(S2—)
B 错误,S2-水解,c(K+) + c(S2—) <0.3mol/L
C 错误,c(K+) = 2c(S2—) +2 c(HS—) +2 c(H2S)
D 正确,遵循质子守恒。
本题难度:一般
5、选择题 常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A.c(R2-)+ c(OH-)=c(Na+)+c(H+)
B.c(R2-)>c(Na+)>c(H+)=c(OH-)
C.混合后溶液的体积为2aL
D.2c(R2-)+ c(HR-)=c(Na+)
参考答案:D
本题解析:电荷守恒的关系式为2c(R2-)+c(HR-)+ c(OH-)=c(Na+)+c(H+),A错误。
混合液的pH刚好等于7,溶液为中性,c(H+)=c(OH-),再根据电荷守恒可知2c(R2-)+ c(HR-)=c(Na+),可推出:c(R2-)<c(Na+),故B错误,D正确。二元弱酸H2R溶液的体积不等于a L,若等于a L,则反应后的溶液应显酸性,故二元弱酸H2R溶液的体积应小于a L,混合后溶液的体积小于2aL,C错误。
故选D
本题难度:一般