时间:2017-09-24 00:20:57
1、填空题 为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: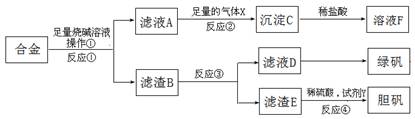
请回答:
(1)操作①的名称是?。
(2)写出反应①的化学方程式?,
反应②的离子反应方程式?。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)?。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是?。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是?,将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是? ? 。
参考答案:(1)?过滤?。
(2)? 2Al + 2NaOH + 2H2O =" 2NaAlO2" + 3H2?,
CO2 + 2H2O + AlO2- ="Al(OH)3" + HCO3-?。
(3)?向溶液中加KSCN 无明显现象,再加入氯水溶液变红,则有Fe3+?
。
(4)? Cu + H2O2 +H2SO4 =" CuSO4" + 2H2O?。
(5)?形成原电池 ?,
直接加热由于Fe3+水解最终得到的是Fe2O3
本题解析:(1)操作1之后得到了滤液和滤渣,所以操作1是过滤。
(2)铝铁铜中只有铝可以与强碱反应所以铝与氢氧化钠反应的化学方程式为 。向偏铝酸钠溶液中通入二氧化碳的反应的离子反应方程式为
。向偏铝酸钠溶液中通入二氧化碳的反应的离子反应方程式为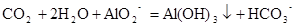 。
。
(3)滤液D经过处理得到了绿矾,七水硫酸亚铁,所以溶液D中含有的金属元素是铁元素,溶液中得铁是以Fe2+形式存在,检验Fe2+的方法是加入KSCN 无明显现象,再加入氯水溶液变红,则有Fe2+,或向滤液D中加入氢氧化钠产生白色沉淀,白色沉淀又变为灰绿色,进而变为红褐色说明溶液中含有Fe2+.
(4)试剂Y为无色液体并结合其与硫酸混合后可以溶解铜单质可以确定该试剂Y具有氧化性,试剂Y是过氧化氢溶液,所以反应的化学方程式为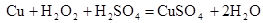 。
。
(5)滤渣B中含有铁和铜两种金属,当向溶液中加入盐酸后形成了原电池所以反应速率增大;Fe3+会发生水解所以若直接加热由于Fe3+水解最终得到的是Fe2O3,所以需要降温结晶的方法制备。
本题难度:简单
2、实验题 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为___________________;在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为:①过滤②洗涤③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明生成物中只有碳酸铜。 
①各装置连接顺序为______(用装置编号表示)
②装置C中装有试剂的名称是_________。
③能证明生成物中只有CuCO3的实验现象是______________________。
(3)若Cu(OH)2和CuCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。 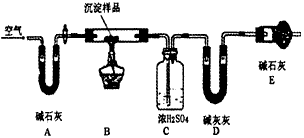
①实验结束时通入过量的空气的作用是_____________________
②实验过程中测定的数据有:
W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成的水的质量,W4:反应后生成二氧化碳的质量,为了测定其组成,至少需要其中________个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.) 
参考答案:(1)Na2CO3+CuSO4 +H2O=Cu(OH)2↓+Na2SO4+CO2↑
(2)①A →C→B;②无水硫酸铜;③ 装置B中澄清石灰水变浑浊,装置C中无水硫酸铜不变蓝色
(3)①将装置中滞留的H2O蒸汽和CO2吹入后面的吸收装置中以完全吸收;②2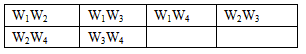
本题解析:
本题难度:一般
3、选择题 不能鉴别AgNO3、BaCl2、Na2CO3、MgCl2四种溶液(不考虑它们之间的相互反应)的试剂是(? )
A.盐酸、硫酸
B.盐酸、NaOH溶液
C.氨水、硫酸
D.氨水、NaOH溶液
参考答案:D
本题解析:
正确答案:D
A、盐酸鉴别出AgNO3、Na2CO3,再用硫酸鉴别出BaCl2、MgCl2?B、盐酸鉴别出AgNO3、Na2CO3,再用NaOH溶液鉴别出BaCl2、MgCl2? C、氨水鉴别出AgNO3、MgCl2,再用硫酸鉴别出BaCl2、Na2CO3? D、无法全部鉴别出,氨水鉴别出AgNO3、MgCl2,NaOH溶液无法鉴别出BaCl2、Na2CO3
本题难度:一般
4、简答题 用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中.当滴到最后一滴时红色突然褪去.试回答下列问题:
(1)实验室保存饱和氯水的方法是______.
(2)请写出新制饱和氯水中含有氯元素的物质的化学式______.
(3)产生上述现象的原因可能有两种(简要文字说明):①是由于______;②是由于______.
简述怎样用实验证明红色褪去的原因是①或者②?
______.
参考答案:(1)氯水是液体,应用细口瓶盛装;氯水中HClO光照易分解,所以应用棕色瓶盛放可装在棕色瓶中保存在阴凉、黑暗处,
故答案为:装在棕色瓶中保存在阴凉、黑暗处;
(2)氯气与水反应,发生Cl2+H2O=HCl+HClO,新制饱和氯水中含有氯元素的物质为HCl、HClO、Cl2,
故答案为:HCl、HClO、Cl2;
(3)氢氧化钠酚酞溶液呈红色,向其中加入新制氯水,红色褪去,原因可能为:①酚酞被强氧化剂HClO氧化而破坏;②NaOH被氯水中的酸性物质中和,红色褪去,证明褪色的原因向所得溶液中再滴入几滴NaOH溶液,若溶液又恢复成红色,原因②对;若无变化,原因①对,
故答案为:酚酞被强氧化剂HClO氧化而破坏;NaOH被氯水中的酸性物质中和,红色褪去;向所得溶液中再滴入几滴NaOH溶液,若溶液又恢复成红色,原因②对,若无变化原因①对.
本题解析:
本题难度:一般
5、实验题 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题: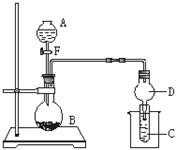
⑴图中D装置在实验中的作用是?。
⑵若 A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)?饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程为?。
⑶若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现是??;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的离子反应方程式??。
⑷若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是?,C中发生反应的离子方程式为?。
(5)若B为块状大理石,C为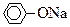 溶液,实验中观察到溶液变浑浊,则酸A不宜用下列的________。
溶液,实验中观察到溶液变浑浊,则酸A不宜用下列的________。
A.HCl
B.HNO3
C.H2SO4
D.CH3COOH
参考答案: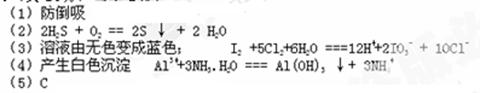
本题解析:略
本题难度:一般