时间:2017-09-24 00:07:22
1、填空题 现有甲、乙、丙、丁四种晶胞,如图所示,可推知:甲晶体中A与B的离子个数比为_____;乙晶体的化学式为______;丙晶体的化学式为______;丁晶体的化学式为____。 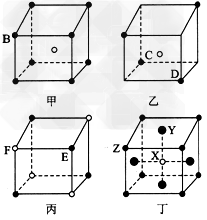
参考答案:1:1;C2D;EF;XY2Z
本题解析:
本题难度:一般
2、实验题 (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题: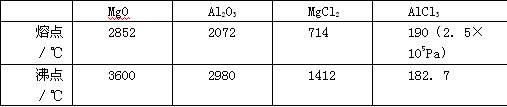
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因?;不用电解AlCl3的方法生产铝的原因?。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为?。
(3)写出Cu+的核外电子排布式?。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是?。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是?。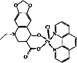
A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①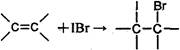
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是?,碘瓶不干燥会发生反应的化学方程式?。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是?。
(3)步骤Ⅲ中所加指示剂为?,滴定终点的现象?。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有?。
参考答案:
本题解析:略
本题难度:一般
3、计算题 (12分)几何学是解决物质结构问题的基础。C60(每个碳原子与周围3个碳原子相连,如下图)是一系列碳原子簇合物(即富勒烯)的一个典型代表,它的应用十分广泛,涉及光学、信息学、药物学、催化、储氢、超导等。就其结构而言也很特殊。18世纪俄罗斯数学家莱昂哈德·欧拉通过理论论证,明确指出任何一个这样的多面体都必须恰好具有12个五边形方能闭合成多面体。试回答: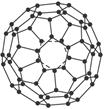
(1)由12个五边形构成的最小碳笼的化学式为__________________________________,计算过程为_________________________。
(2)除碳原子能形成笼形球状分子外,实验中还发现了以金属原子部分取代碳原子的“金属——碳原子”团簇分子,即金属碳烯,若金属碳烯的价电子总数与碳原子团簇分子的价电子总数相等,你认为能代替碳原子的金属有____________________________________(填在周期表中的位置)。
(3)在最小的金属碳烯原子簇化合物中,金属与碳原子个数比为2∶3,这种最小金属碳烯团簇分子的化学式为_____________________________(用M代金属)。
(4)计算机技术的发展带动了理论化学的发展。最近,美国研究人员通过理论计算证明,可以用24个X原子和24个Y原子代替48个碳原子形成C12X24Y24新的团簇分子。若已知这种全非金属团簇分子与C60价电子总数相等,且X、Y、C元素位于同一周期,X的原子半径小于Y的原子半径,则在12个五边形中,每个五边形中有___________个X原子,有___________个Y原子,X是___________元素,Y是___________元素。
(5)目前,化学家已经找到十余种富勒烯家族成员,如C28、C32、C50、C60、C70……(富勒烯家族成员还在增加),它们的分子结构都是由正五边形和正六边形构成的封闭的凸多面体,则C80结构中五边形和六边形的个数分别是_________和_________。
(6)下列物质不属于富勒烯家族的有___________。
A.C18
B.C44
C.C72
D.C83
(7)晶体硼的基本结构单元是由硼原子组成的正二十面体(如下图所示)。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子。请根据观察和计算确定: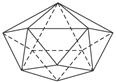
①该基本结构单元内,所含硼原子的个数为__________;所含B—B键的数目是__________。
②若将晶体硼结构单元的每个顶角削去,余下部分就和C60晶体的结构相同。据此确定,C60是由__________个正六边形和__________个正五边形构成。
参考答案:(1)C20? 12×5/3=20
(2)ⅣA或ⅣB的金属?(3)M8C12
(4)2? 2? N? B?(5)12? 30?(6)AD
(7)①12? 30?②12? 20
本题解析:(1)根据“一个碳原子与另三个碳原子相连”的结构特点,很快可以算出由12个五边形构成的最小碳笼分子中含有的碳原子个数为12×5/3=20。(2)价电子数相等,即最外层电子数相等(对同主族元素而言),所以能代替碳原子的金属应是?ⅣA或?ⅣB的金属。(3)因为最小的碳烯原子簇化合物共有20个原子,所以该金属碳烯团簇的化学式为M8C12。(4)因为C12X24Y24与C60价电子总数相等,所以元素X、Y可以有B、N或Be、O或Li、F等多种组合。但是X、Y全是非金属,且原子半径X<Y,所以X是N,Y是B。显然每个五边形中有2个X原子,2个Y原子,1个C原子。(5)由题意知,C80中一定有12个五边形,设C80中六边形的个数为Y,则有(12×5+6Y)/3=80,所以Y=30。(6)富勒烯家族中最小碳原子数为20,所以A不正确;又因为碳原子数必为偶数,所以D也不正确。也可以利用第(5)小题的方法验证B和C选项,其属于富勒烯家族。(7)观?察所给晶体结构示意图,可知在晶体硼中,每个硼原子为5个等边三角形所共有。因此,每个三角形中所含硼原子数目为3× ,该基本结构单元中含硼原子数目为20×
,该基本结构单元中含硼原子数目为20× =12;又因为每条边(B—B键)为2个三角形所共有,因此,该基本结构单元中所含B—B键数目为20×3×
=12;又因为每条边(B—B键)为2个三角形所共有,因此,该基本结构单元中所含B—B键数目为20×3×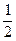 =30。若削去晶体硼结构单元中的一个顶角,则得到一个正五边形(数学上,一个平行于正五棱锥底面的平面与正五棱锥相截,所得截面为一正五边形)。因晶体硼结构单元中每一个顶角都为B原子所占有,晶体硼结构单元中共有12个硼原子,故一共可得12个正五边形。另外,一个等边三角形切去三个顶点后,得到正六边形,因晶体硼结构单元中共有20个等边三角形,故最终将得到20个正六边形。
=30。若削去晶体硼结构单元中的一个顶角,则得到一个正五边形(数学上,一个平行于正五棱锥底面的平面与正五棱锥相截,所得截面为一正五边形)。因晶体硼结构单元中每一个顶角都为B原子所占有,晶体硼结构单元中共有12个硼原子,故一共可得12个正五边形。另外,一个等边三角形切去三个顶点后,得到正六边形,因晶体硼结构单元中共有20个等边三角形,故最终将得到20个正六边形。
本题难度:简单
4、选择题 下列关于晶体的说法一定正确的是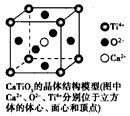
[? ]
A.分子晶体中都存在共价键
B.CaTiO3品体中每个Ti4+与12个O2-相紧邻
C.SiO2晶体中每个硅原子与2个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
参考答案:B
本题解析:
本题难度:简单
5、选择题 制造光导纤维的材料是一种纯度很高的硅氧化物,它是具有立体网状结构的晶体,图3-15是其简化了的平面示意图,下列关于这种材料的说法中正确的是( )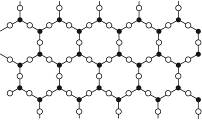
图3-15
A.晶体中Si与O的数目比是1∶4
B.晶体中Si与O的数目比是1∶6
C.该物质是原子晶体
D.该物质是分子晶体
参考答案:C
本题解析:为了确定晶体中Si与O的数目比,可以考察任意一个多边形。每一个多边形有6个硅原子和6个氧原子,但是,每个氧原子都是由两个多边形共用的,每个硅原子都是由4个多边形共用,所以属于一个多边形的氧原子是3个,硅原子是1.5个,Si与O的数目比是1∶2。A、B选项都是错误的。该晶体是“具有立体网状结构的晶体”,因此是原子晶体而非分子晶体,所以C选项正确,而D选项错误。
本题难度:简单