时间:2017-09-24 00:07:22
1、选择题 下列物质属于非晶体的是(?)。
①松香;②冰;③石英;④沥青;⑤铜;⑥纯碱
A.①②③④⑤⑥
B.①④
C.①③
D.⑤⑥
参考答案:B
本题解析:松香在温度升高后会变软,沥青铺成的路面在高温的夏天将变软,因此二者均无固定熔点,所以它们属于非晶体。
本题难度:简单
2、选择题 2011年10月5日瑞典皇家科学院宣布以色列科学家达尼埃尔?谢赫特曼因发现准晶体独享2011年诺贝尔化学奖。由于准晶体原子排列不具周期性,因此准晶体材料硬度很高,同时具有一定弹性,不易损伤,使用寿命长。这种材料的应用有较大发展空间。下列说法不正确的是
[? ]
A.准晶体是一种介于晶体和非晶体之间的固体?
B.构成晶体的微粒在空间呈现有规则的重复排列
C.自然界的固态物质分为晶体和非晶体?
D.液晶不是准晶体
参考答案:C
本题解析:
本题难度:简单
3、填空题 (12分)⑴第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为? ▲?。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为? ▲?。在四大晶体类型中,GaN属于? ▲?晶体。
⑵铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有? ▲?的原子或离子
⑶CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题: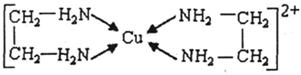
① H、N、O三种元素的电负性由大到小的顺序是? ▲?。
②SO2分子的空间构型为? ▲ 。与SnCl4互为等电子体的一种离子的化学式为? ▲
③乙二胺分子中氮原子轨道的杂化类型为? ▲?。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是? ▲?来源:www.91exam.org。
④⑶中所形成的配离子中含有的化学键类型有? ▲?。
a.配位键? b.极性键? c.离子键? d.非极性键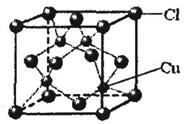
⑤CuCl的晶胞结构如上图所示,其中Cl原子的配位数为? ▲?。
参考答案:(12分)
⑴1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)(1分)
正四面体(1分)原子晶体(1分)
⑵能够接受孤电子对的空轨道(1分)
⑶①?O >N >H(1分)
②V形(1分)? SO42-、SiO44-等(1分)
③sp3杂化(1分)?乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键(1分)
④abd?(2分)?⑤4(1分)
本题解析:略
本题难度:简单
4、填空题 短周期元素A、B、C、D、E、F的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子排布为nsnnpn;C是地壳中含量最高的元素;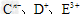 具有相同的电子层结构,E、F的质子数之和是
具有相同的电子层结构,E、F的质子数之和是 电子数的3倍。试回答下列问题:
电子数的3倍。试回答下列问题:
(1)A与B组成的一种分子中所有原子共直线,该分子中B原子杂化方式是__________。
(2)D与F形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元。(图中小黑点、小白圈分别代表阴、阳离子) 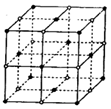
①此结构单元中与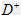 距离最近且相等的
距离最近且相等的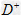 离子个数为_____________。
离子个数为_____________。
②已知该晶体的密度为rg/cm3,该化合物摩尔质量Mg/mol,阿伏加德罗常数为NA,则在该晶体里距离最近的阳离子和阴离子之间的核间距大约是:_____________cm。
(3)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为_______________________。
参考答案:(1)sp
(2)①12;?②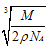 ?
?
(3)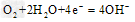
本题解析:
本题难度:一般
5、选择题 用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
参考答案:D
本题解析:
本题难度:简单